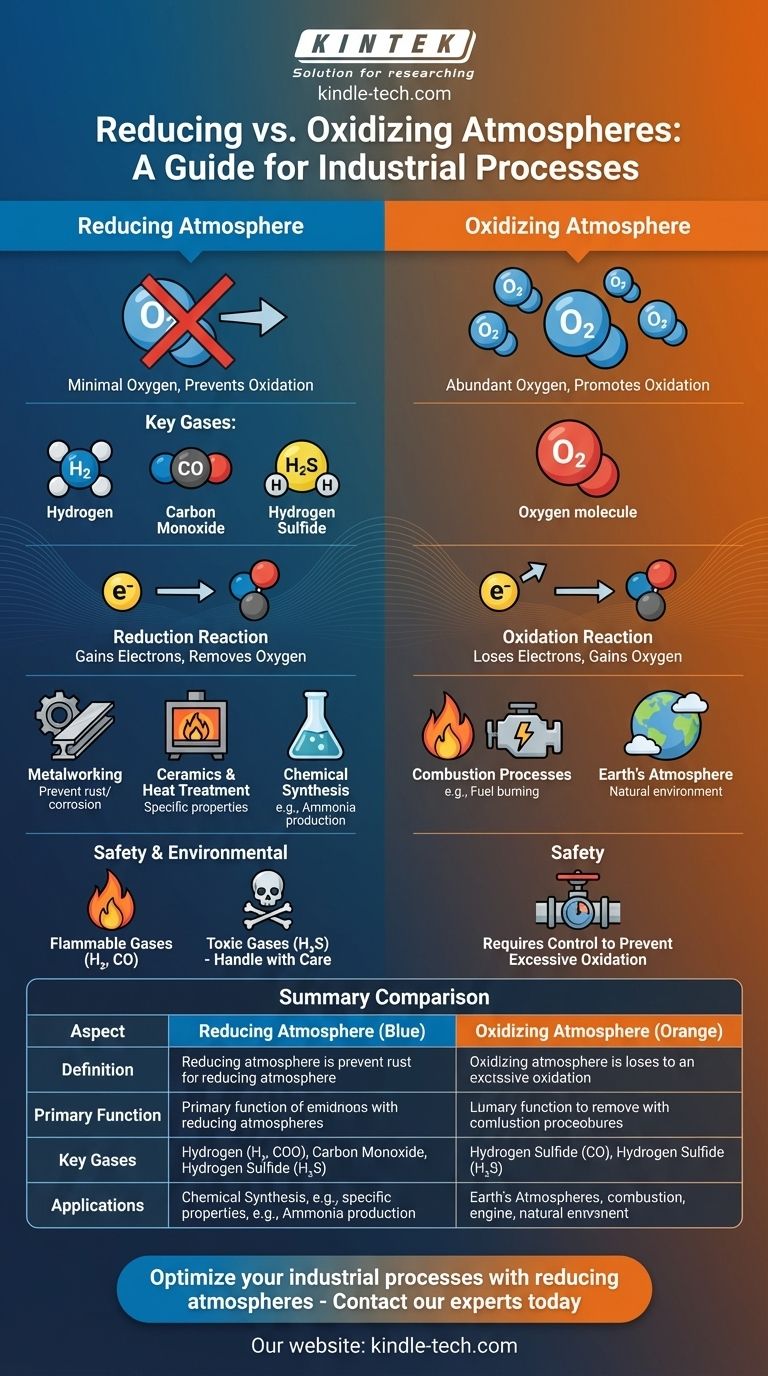
Une atmosphère réductrice est un environnement gazeux où la présence d'oxygène et d'autres agents oxydants est minimisée ou éliminée, empêchant ainsi les processus d'oxydation. Elle contient plutôt des gaz tels que l'hydrogène, le monoxyde de carbone et le sulfure d'hydrogène, qui favorisent les réactions de réduction. Ce type d'atmosphère est souvent utilisé dans les procédés industriels, tels que le travail des métaux et la céramique, pour prévenir l'oxydation et obtenir des propriétés matérielles spécifiques. Inversement, une atmosphère oxydante contient beaucoup d'oxygène, facilitant les réactions d'oxydation. Comprendre la distinction entre ces atmosphères est crucial pour les applications en science des matériaux, en fabrication et en études environnementales.

Points clés expliqués :
-
Définition d'une atmosphère réductrice :
- Une atmosphère réductrice se caractérise par l'absence ou la présence minimale d'oxygène et d'autres gaz oxydants.
- Elle contient des gaz tels que l'hydrogène (H₂), le monoxyde de carbone (CO) et le sulfure d'hydrogène (H₂S), capables de céder des électrons et de favoriser les réactions de réduction.
- Les réactions de réduction impliquent le gain d'électrons par une substance, conduisant souvent à l'élimination de l'oxygène des composés.
-
Objectif et applications :
- Prévention de l'oxydation : Une atmosphère réductrice est utilisée pour prévenir l'oxydation, qui peut dégrader les matériaux ou altérer leurs propriétés. Par exemple, dans le travail des métaux, elle aide à maintenir l'intégrité des métaux en prévenant la rouille ou la corrosion.
- Procédés industriels : Elle est essentielle dans des procédés tels que le recuit, le frittage et le traitement thermique des métaux et des céramiques, où des atmosphères contrôlées sont nécessaires pour obtenir des caractéristiques matérielles spécifiques.
- Réactions chimiques : Dans la synthèse chimique, une atmosphère réductrice peut faciliter les réactions nécessitant la réduction de composés, comme la production d'ammoniac (NH₃) à partir d'azote (N₂) et d'hydrogène (H₂).
-
Comparaison avec l'atmosphère oxydante :
- Atmosphère oxydante : Cet environnement contient beaucoup d'oxygène, favorisant les réactions d'oxydation où les substances perdent des électrons. Elle est courante dans les processus de combustion et les environnements comme l'atmosphère terrestre.
-
Différences clés :
- Les atmosphères réductrices préviennent l'oxydation, tandis que les atmosphères oxydantes la favorisent.
- Les atmosphères réductrices sont utilisées dans des procédés où l'oxydation est indésirable, alors que les atmosphères oxydantes sont utilisées là où l'oxydation est nécessaire, comme dans la combustion des carburants.
-
Exemples de gaz réducteurs :
- Hydrogène (H₂) : Un gaz très réactif qui cède facilement des électrons, ce qui en fait un agent réducteur puissant.
- Monoxyde de carbone (CO) : Souvent utilisé dans les milieux industriels pour réduire les oxydes métalliques en métaux purs.
- Sulfure d'hydrogène (H₂S) : Un gaz réducteur qui peut participer à des réactions de réduction, bien qu'il soit moins couramment utilisé en raison de sa toxicité.
-
Considérations environnementales et de sécurité :
- Manipulation des gaz réducteurs : De nombreux gaz réducteurs, tels que l'hydrogène et le monoxyde de carbone, sont inflammables et nécessitent une manipulation prudente pour prévenir les explosions ou les incendies.
- Toxicité : Certains gaz réducteurs, comme le sulfure d'hydrogène, sont toxiques et nécessitent une ventilation adéquate et des protocoles de sécurité.
- Impact environnemental : L'utilisation d'atmosphères réductrices dans les procédés industriels doit être gérée pour minimiser les dommages environnementaux, tels que le rejet de sous-produits nocifs.
-
Rôle dans les milieux naturels et industriels :
- Atmosphères réductrices naturelles : Rares sur Terre mais peuvent se produire dans des environnements spécifiques, tels que les évents hydrothermaux des grands fonds marins ou certains habitats microbiens.
- Atmosphères réductrices industrielles : Couramment créées dans des environnements contrôlés pour les procédés de fabrication, comme dans les fours ou les réacteurs, afin d'obtenir les propriétés matérielles ou les réactions chimiques souhaitées.
En comprenant les principes et les applications des atmosphères réductrices et oxydantes, les industries peuvent optimiser les procédés, améliorer les performances des matériaux et assurer la conformité en matière de sécurité et d'environnement.
Tableau récapitulatif :
| Aspect | Atmosphère réductrice | Atmosphère oxydante |
|---|---|---|
| Définition | Oxygène minimal, contient des gaz réducteurs (ex. : H₂, CO, H₂S) | Oxygène abondant, favorise les réactions d'oxydation |
| Fonction principale | Prévient l'oxydation, favorise les réactions de réduction | Facilite les réactions d'oxydation |
| Applications | Travail des métaux, céramique, synthèse chimique, traitement thermique | Procédés de combustion, atmosphère terrestre |
| Gaz clés | Hydrogène (H₂), Monoxyde de carbone (CO), Sulfure d'hydrogène (H₂S) | Oxygène (O₂) |
| Considérations de sécurité | Les gaz inflammables (ex. : H₂, CO), les gaz toxiques (ex. : H₂S) nécessitent une manipulation prudente | Moins dangereux mais nécessite un contrôle pour éviter une oxydation excessive |
Optimisez vos procédés industriels avec des atmosphères réductrices — contactez nos experts dès aujourd'hui pour des solutions sur mesure !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Pourquoi un four à atmosphère de haute précision et haute température est-il nécessaire pour le processus d'austénitisation de l'alliage SA508 ?
- Quel est l'objectif d'une atmosphère inerte ? Un guide pour protéger vos matériaux et vos processus
- Quels sont les effets des gaz inertes ? Découverte de leurs risques cachés et de leurs utilisations industrielles
- Quel est le but de l'utilisation d'un four de chauffage à atmosphère contrôlée pour la réduction du Cu ? Atteindre des états catalytiques actifs
- Quelle est la nécessité de maintenir un flux continu d'azote gazeux ? Protéger l'intégrité du nanocomposite argent/oxyde de zinc
- Pourquoi les fours à atmosphère à haute température sont-ils nécessaires pour les catalyseurs zéolithiques à métaux confinés ? Precision Lab Solutions
- Quel rôle le débit de gaz joue-t-il dans le maintien des atmosphères de four ? Contrôle maître pour la qualité et l'efficacité
- Qu'est-ce qu'une atmosphère oxydante ? Aperçus clés sur les réactions d'oxydation et les applications



















