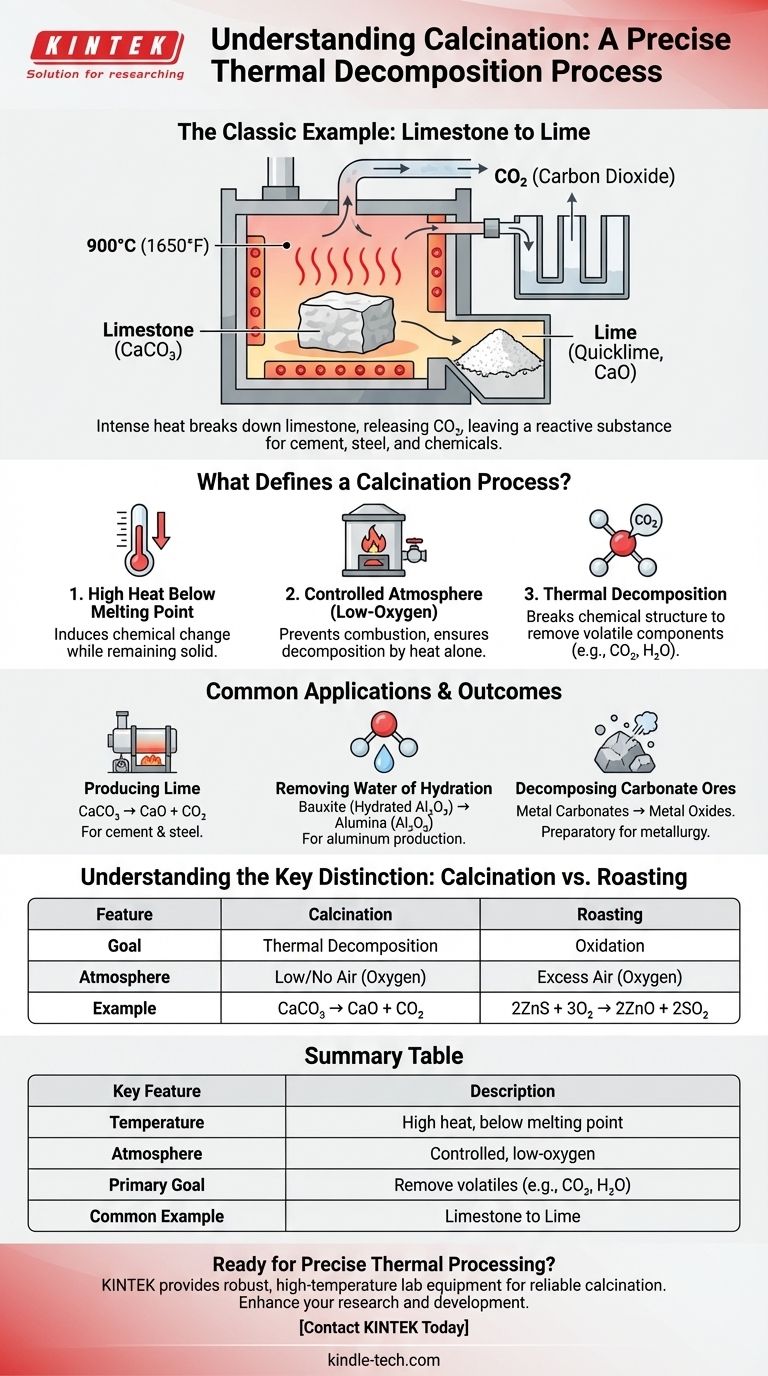
L'exemple classique de calcination est le chauffage du calcaire (carbonate de calcium) pour produire de la chaux (oxyde de calcium). Dans ce processus, la chaleur intense décompose le calcaire, provoquant la libération de dioxyde de carbone gazeux et laissant derrière elle une substance poudreuse et plus réactive. Il s'agit d'un processus fondamental utilisé depuis des siècles dans la production de ciment et d'autres matériaux industriels.
La calcination n'est pas simplement un chauffage ; c'est un processus précis de décomposition thermique. Il utilise des températures élevées inférieures au point de fusion du matériau dans une atmosphère contrôlée et pauvre en oxygène pour éliminer les composants volatils tels que le dioxyde de carbone ou l'eau.

Qu'est-ce qui définit un processus de calcination ?
Pour identifier véritablement la calcination, vous devez regarder au-delà de la simple application de chaleur. Trois conditions spécifiques définissent le processus et le distinguent des autres traitements thermiques comme la torréfaction ou le séchage.
Le rôle de la chaleur élevée
La calcination implique de chauffer un matériau solide à une température très élevée. De manière critique, cette température est maintenue en dessous du point de fusion du matériau.
L'objectif est d'induire un changement chimique ou une décomposition tandis que le matériau reste à l'état solide, le rendant souvent cassant ou poreux.
Une atmosphère contrôlée
Le processus est mené en absence ou avec un apport très limité d'air (oxygène). C'est un différenciateur clé par rapport aux autres processus thermiques.
En limitant l'oxygène, la calcination empêche la combustion ou une oxydation significative. L'objectif principal est la décomposition uniquement due à la chaleur, et non à la réaction avec l'air.
L'objectif : la décomposition thermique
Le but fondamental de la calcination est de décomposer la structure chimique d'une substance.
Cette décomposition entraîne l'élimination d'un composant volatil du solide. La partie qui est éliminée est généralement un gaz, tel que le dioxyde de carbone (CO2) des carbonates ou la vapeur d'eau (H2O) des minéraux hydratés.
Applications et résultats courants
Bien que la production de chaux soit le cas d'école, la calcination est utilisée dans diverses industries pour transformer des matériaux.
Production de chaux à partir de calcaire
C'est l'exemple le plus courant. Le calcaire (CaCO₃) est chauffé à des températures d'environ 900°C (1650°F). Il se décompose en chaux vive (CaO) et libère du dioxyde de carbone gazeux.
Cette chaux est un ingrédient crucial dans la fabrication du ciment, de l'acier et de certains produits chimiques.
Élimination de l'eau d'hydratation
La calcination est largement utilisée pour éliminer l'eau chimiquement liée des minéraux hydratés.
Par exemple, le minerai de bauxite, une forme hydratée d'oxyde d'aluminium, est calciné pour éliminer l'eau et produire de l'alumine pure (Al₂O₃), la principale matière première pour la production de métal aluminium.
Décomposition des minerais carbonatés
Semblable au calcaire, d'autres minerais carbonatés métalliques sont calcinés pour les convertir en leurs formes oxydes. C'est souvent une étape préparatoire en métallurgie, car les oxydes métalliques sont généralement plus faciles à réduire en métal pur que leurs formes carbonatées d'origine.
Comprendre les distinctions clés
Un point de confusion fréquent est de différencier la calcination d'un processus similaire appelé torréfaction. La distinction est essentielle et réside entièrement dans l'objectif et l'atmosphère utilisée.
Calcination par rapport à la torréfaction
La calcination vise la décomposition thermique en l'absence d'air. Considérez-la comme la "cuisson" d'un minéral pour le décomposer. Un exemple est CaCO₃ → CaO + CO₂.
La torréfaction, en revanche, consiste à chauffer un minéral en excès d'air (oxygène). L'objectif est l'oxydation, souvent pour convertir les minerais sulfurés en oxydes. Un exemple est 2ZnS + 3O₂ → 2ZnO + 2SO₂.
Pourquoi contrôler l'atmosphère ?
Limiter l'air pendant la calcination est essentiel pour éviter les réactions secondaires indésirables. Si de l'oxygène était présent lors du chauffage du calcaire, par exemple, cela ne changerait pas fondamentalement la réaction principale, mais pour d'autres matériaux, cela pourrait entraîner une oxydation indésirable.
Le contrôle de l'atmosphère garantit que la décomposition thermique est la transformation dominante et souhaitée.
Comment identifier un processus de calcination
Sur la base de ces principes, vous pouvez facilement identifier si un processus est un exemple de calcination.
- Si votre objectif est de décomposer un minerai carbonaté : Le chauffage du calcaire, de la dolomie ou d'autres carbonates pour éliminer le CO₂ et former un oxyde est un exemple définitif de calcination.
- Si votre objectif est d'éliminer l'eau chimiquement liée : Le chauffage d'un minéral hydraté comme la bauxite ou le gypse pour produire sa forme anhydre (sans eau) est une autre application principale de la calcination.
- Si la distinction clé est l'atmosphère : Un processus impliquant le chauffage d'un solide en dessous de son point de fusion avec peu ou pas d'air pour provoquer une décomposition chimique est une calcination.
Reconnaître ces conditions vous permet de distinguer la calcination comme un outil fondamental de l'ingénierie chimique et des matériaux.
Tableau récapitulatif :
| Caractéristique clé | Description |
|---|---|
| Température | Chaleur élevée, mais inférieure au point de fusion du matériau. |
| Atmosphère | Environnement contrôlé, pauvre en oxygène ou sans oxygène. |
| Objectif principal | Décomposition thermique pour éliminer les composants volatils (par exemple, CO₂, H₂O). |
| Exemple courant | Chauffage du calcaire (CaCO₃) pour produire de la chaux (CaO). |
Prêt à réaliser un traitement thermique précis dans votre laboratoire ?
La calcination est un processus fondamental pour transformer les matériaux, de la décomposition des carbonates à la déshydratation des minéraux. KINTEK se spécialise dans la fourniture des équipements de laboratoire robustes et à haute température — tels que des fours avancés avec contrôle précis de l'atmosphère — dont vous avez besoin pour exécuter ces processus de manière fiable et sûre.
Que vous travailliez dans la science des matériaux, la métallurgie ou le génie chimique, nos solutions sont conçues pour répondre aux exigences rigoureuses de votre recherche et développement. Laissez-nous vous aider à améliorer les capacités de votre laboratoire.
Contactez KINTEK dès aujourd'hui pour discuter de vos besoins spécifiques en matière de traitement thermique et découvrir l'équipement adapté à votre application.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif à tubes multiples zones chauffantes divisées
- Four rotatif électrique pour pyrolyse de biomasse
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quel est le but d'un calcinateur ? Améliorer l'efficacité du traitement à haute température
- Quels sont les types de réacteurs de pyrolyse utilisés dans l'industrie ? Choisissez la bonne technologie pour votre produit
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quel est le principe du four rotatif ? Maîtriser le traitement thermique continu
- Quelles sont les applications industrielles de la pyrolyse ? Transformer les déchets en énergie et en produits de valeur



















