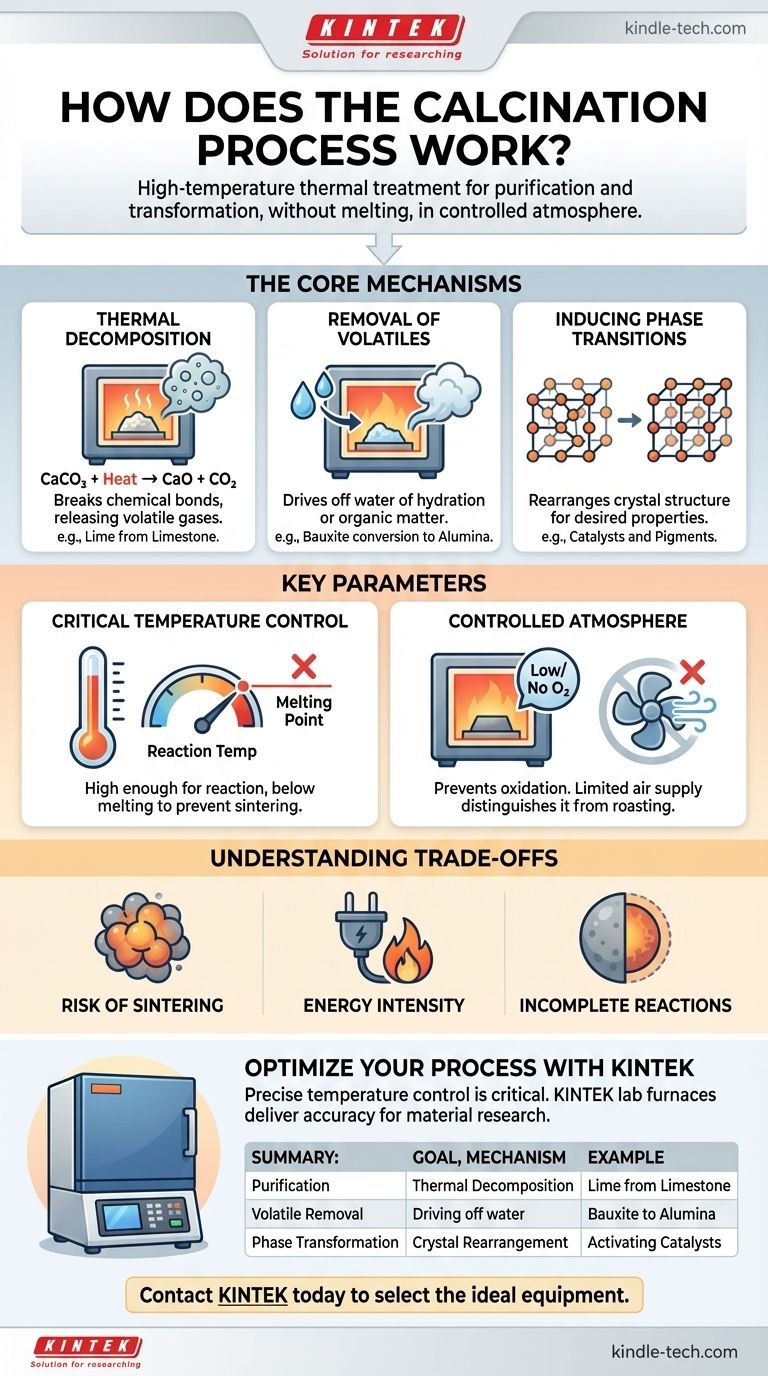
Essentiellement, la calcination est un processus de purification et de transformation entraîné par la chaleur. C'est un type spécifique de traitement thermique appliqué aux matériaux solides, où ils sont chauffés à une température élevée mais inférieure à leur point de fusion. Cela est réalisé en l'absence ou avec un apport très limité d'air, ce qui est un détail critique qui la distingue des autres processus thermiques. Les objectifs principaux sont d'induire une décomposition thermique, d'éliminer les substances volatiles comme l'eau ou le dioxyde de carbone, ou de déclencher un changement dans la structure cristalline du matériau.
La calcination ne consiste pas simplement à chauffer un matériau ; c'est un processus thermique précis conçu pour modifier la composition chimique ou la structure physique d'un matériau sans le faire fondre. La clé est de contrôler la température et l'atmosphère pour obtenir un résultat spécifique, comme la décomposition ou la purification.

Les mécanismes fondamentaux de la calcination
La calcination atteint ses résultats par plusieurs changements physiques et chimiques distincts. L'objectif spécifique du processus détermine lequel de ces mécanismes est le plus important.
Décomposition thermique
C'est l'objectif le plus courant de la calcination. Le processus applique suffisamment d'énergie thermique pour briser les liaisons chimiques au sein d'un composé, le décomposant en substances plus simples.
Un exemple industriel classique est la production de chaux (oxyde de calcium) à partir de calcaire (carbonate de calcium). Lorsqu'il est chauffé, le carbonate se décompose, libérant du dioxyde de carbone gazeux.
CaCO₃ (solide) + Chaleur → CaO (solide) + CO₂ (gaz)
L'oxyde de calcium résultant est un composant fondamental dans la fabrication du ciment et de l'acier.
Élimination des substances volatiles
De nombreux minéraux bruts contiennent de l'eau, soit physiquement absorbée, soit chimiquement liée au sein de leur structure cristalline (connue sous le nom d'eau d'hydratation). La calcination fournit l'énergie nécessaire pour éliminer cette eau sous forme de vapeur.
Par exemple, la conversion de la bauxite en alumine pour la production d'aluminium implique une calcination pour éliminer son eau d'hydratation. De même, ce processus est utilisé pour éliminer la matière organique volatile de divers matériaux.
Induction de transitions de phase
Parfois, l'objectif n'est pas de modifier la composition chimique mais d'altérer les propriétés physiques du matériau. Le chauffage d'un matériau peut provoquer le réarrangement de ses atomes en une structure cristalline différente, souvent plus stable ou fonctionnellement utile.
Ceci est courant dans la production de catalyseurs et de pigments céramiques, où une phase cristalline spécifique possède l'activité catalytique ou la couleur désirée.
Paramètres clés qui définissent le processus
La calcination réussie d'un matériau nécessite un contrôle précis de plusieurs variables. Ces paramètres dictent l'efficacité et le résultat de l'ensemble du processus.
Le rôle critique de la température
La température de calcination doit être soigneusement contrôlée. Elle doit être suffisamment élevée pour fournir l'énergie d'activation pour la réaction souhaitée (par exemple, la décomposition) mais doit rester strictement inférieure au point de fusion du matériau.
Si la température est trop basse, la réaction sera incomplète. Si elle est trop élevée, le matériau peut fondre ou se fritter (fusionner), ce qui est généralement un résultat indésirable.
L'atmosphère contrôlée
La calcination est définie par son environnement à faible teneur en oxygène ou sans oxygène. Ceci est crucial pour prévenir l'oxydation, qui est une réaction chimique entièrement différente.
Les processus qui chauffent les matériaux en présence d'air abondant pour provoquer délibérément l'oxydation sont connus sous le nom de grillage, et non de calcination. Cette distinction est fondamentale en métallurgie et en science des matériaux.
Comprendre les compromis et les limites
Bien que puissante, la calcination n'est pas sans défis. Comprendre ses limites est essentiel pour l'appliquer efficacement.
Risque de frittage
Un mauvais contrôle de la température est le risque principal. Si la température s'approche trop du point de fusion du matériau, les particules individuelles peuvent commencer à fusionner. Ce processus de frittage réduit la surface et peut altérer les propriétés souhaitées du produit final.
Intensité énergétique
Maintenir les températures élevées requises pour la calcination (souvent 800-1000°C ou plus) demande une quantité significative d'énergie. Cela en fait un processus coûteux avec une empreinte environnementale notable, en particulier pour des réactions comme la production de chaux qui libèrent de grands volumes de CO₂.
Réactions incomplètes
Il peut être difficile d'obtenir une réaction complète à 100 %. Si le matériau n'est pas chauffé pendant une durée suffisante, ou si le transfert de chaleur est insuffisant en raison de la taille importante des particules, une partie du matériau original non décomposé peut subsister, compromettant la pureté du produit final.
Faire le bon choix pour votre objectif
Les paramètres spécifiques de votre processus de calcination dépendent entièrement du produit final désiré.
- Si votre objectif principal est de produire un oxyde à partir d'un carbonate : Vous devez vous assurer que la température est suffisamment élevée pour éliminer tout le CO₂ mais suffisamment basse pour éviter le frittage du produit d'oxyde final.
- Si votre objectif principal est d'éliminer l'humidité : Un profil de température plus bas peut être suffisant, en se concentrant sur l'élimination de l'eau sans déclencher de décomposition chimique indésirable.
- Si votre objectif principal est d'obtenir une phase cristalline spécifique : Un contrôle précis de la température et du temps de maintien est primordial, car les transitions de phase se produisent dans des fenêtres de température spécifiques.
En fin de compte, maîtriser la calcination consiste à la comprendre comme un outil permettant d'ingénierie précisément les propriétés finales d'un matériau grâce à une énergie thermique contrôlée.
Tableau récapitulatif :
| Objectif de la calcination | Mécanisme clé | Exemple d'application |
|---|---|---|
| Purification / Décomposition | Décomposition thermique de composés (par exemple, carbonates). | Production de chaux (CaO) à partir de calcaire (CaCO₃). |
| Élimination des substances volatiles | Élimination de l'eau (hydratation) ou d'autres substances volatiles. | Conversion de la bauxite en alumine pour la production d'aluminium. |
| Transformation de phase | Réarrangement de la structure cristalline pour modifier les propriétés du matériau. | Activation de catalyseurs ou développement de pigments céramiques. |
Prêt à optimiser votre processus de calcination ?
Un contrôle précis de la température est essentiel pour une calcination réussie. KINTEK est spécialisé dans les fours de laboratoire haute performance qui offrent la précision et la fiabilité dont votre laboratoire a besoin pour la purification des matériaux, la décomposition et la recherche sur la transformation de phase.
Contactez KINTEK dès aujourd'hui pour discuter de votre application spécifique. Nos experts vous aideront à sélectionner l'équipement idéal pour atteindre vos objectifs en science des matériaux.
Guide Visuel
Produits associés
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- À quoi sert le four à moufle pour la teneur en cendres ? Obtenez une analyse gravimétrique précise
- Quelle est la température de fusion des céramiques ? Comprendre la performance des matériaux à haute température
- Quelle doit être la température d'un four à moufle pour la teneur en cendres ? Obtenez des résultats précis avec la bonne chaleur
- À quelle température la céramique fond-elle ? Un guide sur la résistance thermique de la céramique
- Comment déterminer la teneur en cendres à l'aide d'un four à moufle ? Réalisez une analyse minérale précise



















