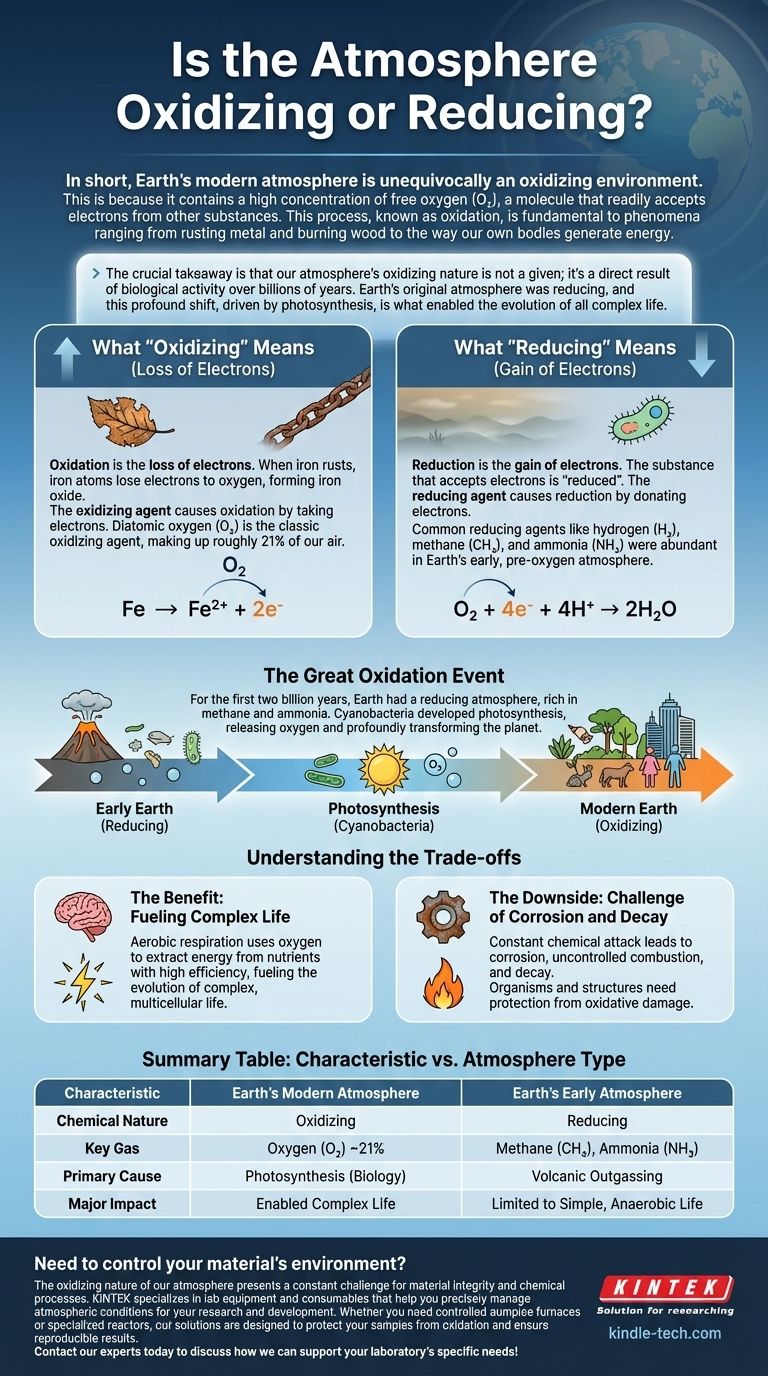
En bref, l'atmosphère moderne de la Terre est sans équivoque un environnement oxydant. Cela est dû à sa forte concentration en oxygène libre (O₂), une molécule qui accepte facilement les électrons d'autres substances. Ce processus, connu sous le nom d'oxydation, est fondamental pour des phénomènes allant de la rouille du métal et de la combustion du bois à la manière dont nos propres corps génèrent de l'énergie.
L'élément crucial à retenir est que la nature oxydante de notre atmosphère n'est pas une donnée ; c'est le résultat direct de l'activité biologique sur des milliards d'années. L'atmosphère originelle de la Terre était réductrice, et ce profond changement, impulsé par la photosynthèse, est ce qui a permis l'évolution de toute vie complexe.

Ce que signifient réellement "oxydant" et "réducteur"
Pour comprendre l'état de notre atmosphère, nous devons d'abord définir les principes chimiques fondamentaux en jeu. Ces termes décrivent le transfert d'électrons entre les molécules.
Le rôle des électrons
L'oxydation est la perte d'électrons. Lorsque le fer rouille, les atomes de fer perdent des électrons au profit de l'oxygène, formant de l'oxyde de fer.
La réduction est le gain d'électrons. La substance qui accepte les électrons est dite "réduite". Dans l'exemple de la rouille, l'oxygène gagne des électrons du fer, donc l'oxygène est réduit.
Identifier un agent oxydant
Un agent oxydant (ou oxydant) est une substance qui provoque l'oxydation en prenant des électrons à autre chose.
En raison de sa puissante tendance à attirer et à accepter les électrons, le dioxygène (O₂) est l'agent oxydant classique et le plus important de notre environnement.
Identifier un agent réducteur
Un agent réducteur (ou réducteur) est une substance qui provoque la réduction en donnant ses électrons à autre chose.
Les agents réducteurs courants comprennent l'hydrogène (H₂), le méthane (CH₄) et l'ammoniac (NH₃). Ceux-ci étaient abondants dans l'atmosphère primitive de la Terre, avant l'oxygène.
La force dominante : pourquoi notre atmosphère est oxydante
Le caractère chimique de notre atmosphère est dicté par une molécule dominante qui représente environ 21 % de l'air que nous respirons.
Le facteur oxygène
La présence d'environ 21 % d'oxygène libre est la principale raison pour laquelle notre atmosphère est oxydante. L'oxygène est très électronégatif, ce qui signifie que ses atomes ont une forte attraction pour les électrons. Cela rend l'O₂ chimiquement agressif et prêt à réagir avec – et à oxyder – une vaste gamme d'autres éléments et composés.
Le grand événement d'oxydation
Notre planète n'a pas toujours été ainsi. Pendant les deux premiers milliards d'années de son histoire, la Terre a eu une atmosphère réductrice, pratiquement exempte d'O₂ et riche en gaz comme le méthane et l'ammoniac.
Cela a changé avec l'évolution des cyanobactéries. Ces microorganismes ont développé la photosynthèse, un processus qui utilise la lumière du soleil pour créer de l'énergie et libère de l'oxygène comme produit de déchet. Sur des centaines de millions d'années, cette activité biologique a lentement et profondément transformé la planète entière, pompant d'énormes quantités d'O₂ dans l'air et la faisant passer à son état oxydant moderne.
Comprendre les compromis
Un environnement riche en oxygène et oxydant présente à la fois un avantage puissant et un défi chimique persistant.
Le bénéfice : alimenter la vie complexe
Le principal avantage est la respiration aérobie. Ce processus métabolique utilise l'oxygène pour extraire l'énergie des nutriments avec une efficacité incroyable – bien plus que les processus anaérobies (sans oxygène) qui l'ont précédé. Ce surplus d'énergie massif est ce qui a alimenté l'évolution de la vie complexe et multicellulaire, y compris nous.
L'inconvénient : le défi de la corrosion et de la décomposition
Le "coût" d'une atmosphère oxydante est une attaque chimique constante. C'est la force derrière la corrosion (comme la rouille), la combustion incontrôlée (le feu) et la décomposition de la matière organique.
Les organismes vivants doivent investir de l'énergie dans des défenses antioxydantes sophistiquées pour protéger leurs cellules des dommages oxydatifs, tandis que toute structure que nous construisons doit être conçue pour résister aux effets incessants de l'oxygène atmosphérique.
Points clés à retenir pour différents contextes
Votre approche de ce fait dépendra de votre domaine et de vos objectifs.
- Si votre objectif principal est la chimie ou la science des matériaux : Reconnaissez que toute substance exposée à notre air est dans une bataille constante contre l'oxydation, un facteur critique influençant la sélection, la conservation et la durabilité des matériaux.
- Si votre objectif principal est la biologie ou la géologie : Comprenez que le passage d'une atmosphère réductrice à une atmosphère oxydante a été sans doute le changement environnemental le plus significatif de l'histoire de la Terre, dictant tout le cours ultérieur de l'évolution.
- Si votre objectif principal est l'astrobiologie : Utilisez la présence d'une quantité substantielle d'oxygène libre dans l'atmosphère d'une exoplanète comme une biosignature principale, car il est difficile de la maintenir sans une source biologique puissante à l'échelle planétaire.
Comprendre la nature oxydante de notre atmosphère, c'est comprendre le moteur chimique fondamental qui anime à la fois la vie et la décomposition sur notre monde.
Tableau récapitulatif :
| Caractéristique | Atmosphère moderne de la Terre | Atmosphère primitive de la Terre |
|---|---|---|
| Nature chimique | Oxydante | Réductrice |
| Gaz clé | Oxygène (O₂) ~21% | Méthane (CH₄), Ammoniac (NH₃) |
| Cause principale | Photosynthèse (Biologie) | Dégazage volcanique |
| Impact majeur | A permis la vie complexe | Limité à la vie simple et anaérobie |
Besoin de contrôler l'environnement de vos matériaux ? La nature oxydante de notre atmosphère présente un défi constant pour l'intégrité des matériaux et les processus chimiques. KINTEK est spécialisé dans les équipements de laboratoire et les consommables qui vous aident à gérer précisément les conditions atmosphériques pour votre recherche et développement. Que vous ayez besoin de fours à atmosphère contrôlée ou de réacteurs spécialisés, nos solutions sont conçues pour protéger vos échantillons de l'oxydation et garantir des résultats reproductibles. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons répondre aux besoins spécifiques de votre laboratoire !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Comment créer une atmosphère inerte ? Maîtrisez les procédés sûrs et purs grâce à l'inertage
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir l'oxydation et assurer la sécurité
- Comment développer une atmosphère inerte pour une réaction chimique ? Maîtrisez le contrôle atmosphérique précis pour votre laboratoire



















