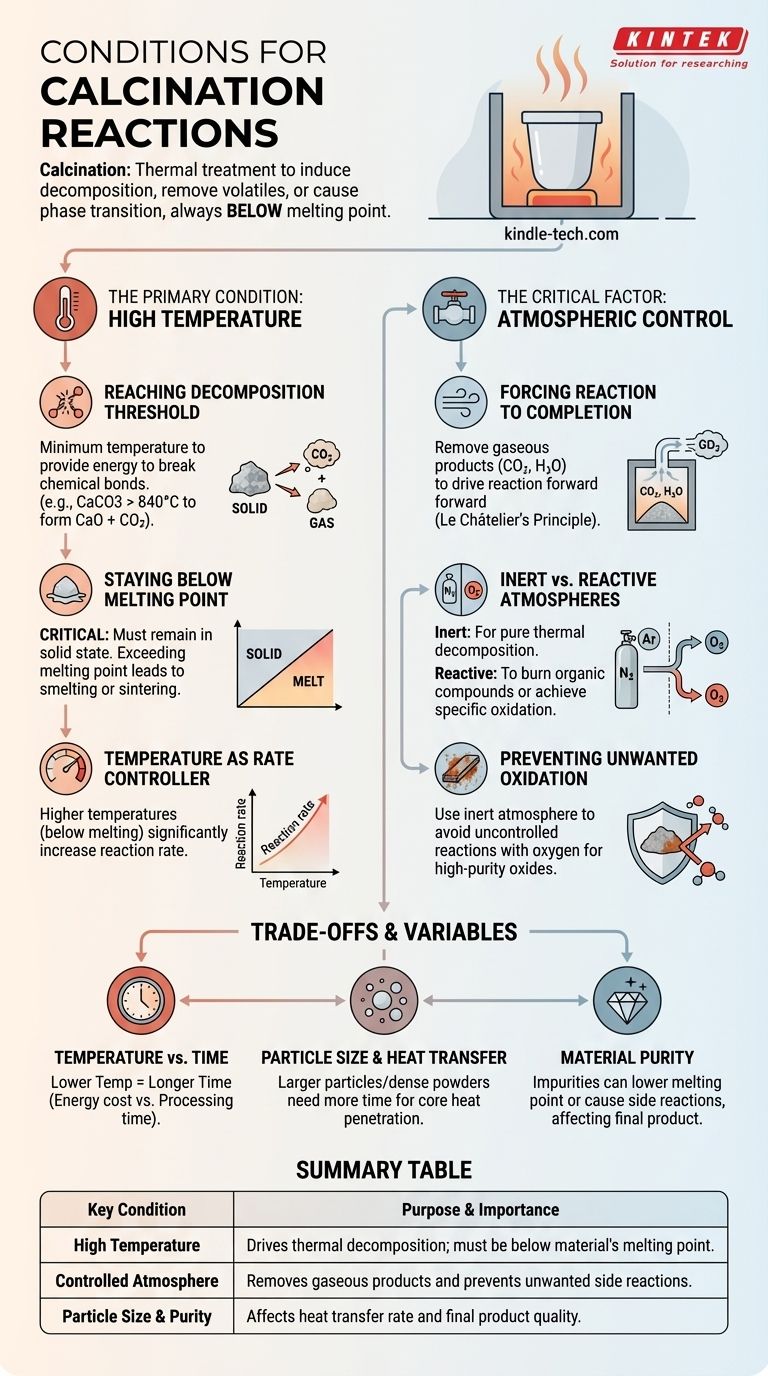
Les réactions de calcination sont induites par des températures élevées, généralement inférieures au point de fusion d'un matériau, et sont menées dans une atmosphère spécifiquement contrôlée. L'objectif est de provoquer une décomposition thermique, d'éliminer les substances volatiles ou de déclencher une transition de phase dans un matériau solide sans le faire fondre.
La calcination est fondamentalement un processus de traitement thermique où une chaleur intense est appliquée à un solide pour obtenir un changement chimique ou physique spécifique. Le succès dépend non seulement de l'atteinte d'une température cible, mais aussi du contrôle précis de l'atmosphère environnante pour favoriser la réaction souhaitée et prévenir les effets secondaires indésirables.

La condition principale : la haute température
L'application de chaleur est la condition la plus fondamentale de la calcination. Cependant, la plage de température spécifique est cruciale et est régie par deux contraintes opposées.
Atteindre le seuil de décomposition
Chaque réaction de calcination nécessite une température minimale pour fournir l'énergie nécessaire à la rupture des liaisons chimiques. Par exemple, le carbonate de calcium (calcaire) doit être chauffé au-dessus de 840 °C (1544 °F) pour vaincre son énergie de liaison et se décomposer en oxyde de calcium (chaux) et en dioxyde de carbone.
Rester en dessous du point de fusion
C'est une caractéristique déterminante de la calcination. Le processus doit se dérouler tant que le matériau est à l'état solide. Si la température dépasse le point de fusion du matériau, le processus n'est plus une calcination ; il devient une fusion ou un frittage, modifiant fondamentalement le résultat et la structure du produit.
La température comme régulateur de vitesse
Bien qu'il existe une température minimale pour la décomposition, l'augmentation de la température (tout en restant en dessous du point de fusion) augmente considérablement la vitesse de la réaction. Les procédés industriels fonctionnent souvent à des températures plus élevées pour garantir que la réaction se termine rapidement et efficacement.
Le facteur critique : le contrôle de l'atmosphère
Le gaz entourant le matériau pendant le chauffage est tout aussi important que la température elle-même. L'atmosphère peut être un participant passif ou actif dans la réaction.
Forcer la réaction à se terminer
De nombreuses réactions de calcination libèrent un gaz, comme le CO₂ ou la vapeur d'eau. Selon le principe de Le Châtelier, l'accumulation de ce gaz peut ralentir, voire inverser, la réaction. Par conséquent, une condition clé est souvent un flux d'air ou un vide qui élimine continuellement le produit gazeux, forçant la décomposition à se poursuivre jusqu'à son terme.
Atmosphères inertes contre réactives
Le choix de l'atmosphère empêche les réactions secondaires indésirables. Une atmosphère inerte, telle que l'azote ou l'argon, est utilisée lorsque l'objectif est une décomposition thermique pure sans oxydation. Une atmosphère réactive, telle que l'air ou l'oxygène pur, est intentionnellement utilisée pour brûler les composés organiques ou atteindre un état d'oxydation spécifique dans le matériau final.
Prévenir l'oxydation indésirable
Lors de la création d'oxydes métalliques de haute pureté, le chauffage du matériau précurseur à l'air libre peut entraîner des réactions incontrôlées avec l'oxygène. L'utilisation d'une atmosphère inerte garantit que la seule réaction en cours est la décomposition thermique prévue, produisant un matériau plus pur.
Comprendre les compromis et les variables
L'obtention des conditions de calcination parfaites implique de mettre en balance plusieurs facteurs concurrents.
Température contre temps
Une température plus basse peut toujours permettre la calcination, mais cela prendra beaucoup plus de temps. Cela crée un compromis pratique entre le coût énergétique du maintien de températures élevées et le temps de traitement requis pour une réaction complète.
Taille des particules et transfert de chaleur
La chaleur doit pénétrer jusqu'au cœur de chaque particule pour que la réaction soit complète. Les particules plus grosses ou une poudre densément tassée nécessitent plus de temps, car le transfert de chaleur vers le centre est plus lent. Une calcination incomplète est un problème courant résultant d'un temps de chauffage insuffisant pour la taille de particule donnée.
Pureté du matériau
Les impuretés dans le matériau de départ peuvent avoir un impact significatif. Elles peuvent abaisser le point de fusion du matériau, entraînant un frittage accidentel, ou provoquer des réactions secondaires non désirées qui contaminent le produit final. La pureté de la matière première est une condition initiale critique.
Faire le bon choix pour votre objectif
Les conditions de calcination optimales dépendent entièrement du résultat souhaité.
- Si votre objectif principal est de produire un produit chimique en vrac comme la chaux : Les conditions principales sont une température bien supérieure au point de décomposition et un flux d'air fort pour éliminer efficacement le CO₂.
- Si votre objectif principal est d'activer un catalyseur ou un adsorbant : Un contrôle précis de la température et une atmosphère spécifique (par exemple, air sec) sont essentiels pour éliminer l'eau ou d'autres volatils sans détruire la structure poreuse délicate du matériau.
- Si votre objectif principal est de préparer une poudre céramique de haute pureté : Les conditions clés sont un matériau de départ de haute pureté, un contrôle précis de la température pour éviter le frittage et une atmosphère adaptée pour prévenir l'oxydation indésirable.
En fin de compte, maîtriser la calcination réside dans la compréhension que la température et l'atmosphère sont des outils précis pour contrôler le destin chimique d'un matériau.
Tableau récapitulatif :
| Condition clé | Objectif et importance |
|---|---|
| Haute température | Induit la décomposition thermique ; doit être inférieure au point de fusion du matériau. |
| Atmosphère contrôlée | Élimine les produits gazeux et prévient les réactions secondaires indésirables. |
| Taille des particules et pureté | Affecte le taux de transfert de chaleur et la qualité du produit final. |
Prêt à perfectionner votre processus de calcination ? KINTEK est spécialisée dans les fours de laboratoire et les équipements haute performance qui offrent un contrôle précis de la température et une gestion de l'atmosphère. Que vous développiez des catalyseurs, synthétisiez des céramiques ou traitiez des minéraux, nos solutions garantissent que vos réactions sont efficaces et reproductibles. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir les besoins spécifiques de calcination de votre laboratoire.
Guide Visuel
Produits associés
- Four rotatif à vide de laboratoire Four rotatif à tube
- Four rotatif à tubes multiples zones chauffantes divisées
- Four rotatif continu scellé sous vide Four rotatif
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
Les gens demandent aussi
- Quels sont les avantages de l'utilisation d'un four tubulaire rotatif pour les catalyseurs MoVOx ? Amélioration de l'uniformité et de la cristallinité
- Quelles conditions de réaction les fours tubulaires à haute température offrent-ils pour la réduction du biochar ? Optimiser le traitement des minerais
- Quelle est la fonction principale d'un four tubulaire rotatif industriel ? Réduction à l'hydrogène de la poudre de tungstène
- Quel est le processus de production du zirconium ? Du minerai au métal et à la céramique haute performance
- Quels sont les avantages et les inconvénients du four rotatif ? Maximiser l'uniformité et l'efficacité du traitement thermique



















