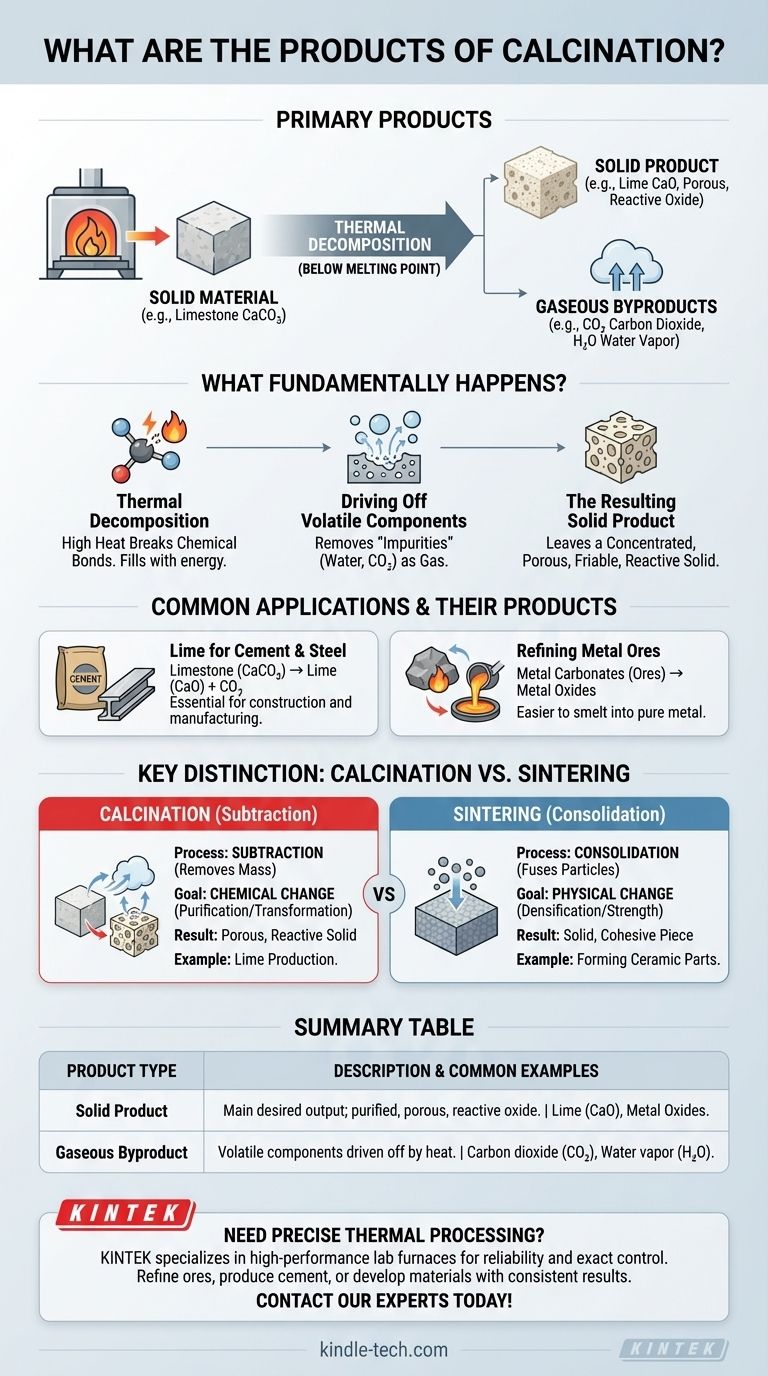
En bref, les principaux produits de la calcination sont un matériau solide qui a subi une décomposition thermique et un ou plusieurs sous-produits gazeux. Par exemple, lorsque le calcaire (carbonate de calcium) est calciné, il se décompose en chaux solide (oxyde de calcium) et en gaz carbonique, qui est expulsé par la chaleur. Le solide résultant est le principal produit souhaité.
La calcination est fondamentalement un processus de purification et de transformation. Son objectif est de chauffer un matériau solide pour le décomposer chimiquement, en expulsant les composants volatils comme l'eau ou le dioxyde de carbone pour produire un solide plus concentré, poreux ou réactif.
Ce qui se passe fondamentalement pendant la calcination ?
Le principe de la décomposition thermique
La calcination est un processus de décomposition thermique, ce qui signifie qu'elle utilise une chaleur élevée pour décomposer un composé en substances plus simples. De manière critique, cela se produit à une température inférieure au point de fusion du matériau.
Le processus force un changement chimique en rompant les liaisons. L'exemple le plus courant est la décomposition d'un carbonate en son oxyde et en dioxyde de carbone gazeux.
L'expulsion des composants volatils
L'objectif principal de la calcination est d'éliminer les substances « volatiles » qui sont chimiquement liées à l'intérieur du solide. La référence note cela comme le « retrait des impuretés ».
Ces substances sont généralement de l'eau (provenant de minéraux hydratés), du dioxyde de carbone (provenant de carbonates comme le calcaire) ou d'autres composés décomposables. Le chauffage fournit l'énergie nécessaire à ces composants pour s'échapper sous forme de gaz.
Le produit solide résultant
Le solide qui reste est le produit principal. C'est souvent un oxyde du matériau d'origine, comme la chaux (CaO) provenant du calcaire (CaCO₃).
À mesure que le gaz s'échappe, il laisse derrière lui une structure poreuse et friable. C'est pourquoi la référence décrit la chaux résultante comme étant dans un « état facilement pulvérisable », ce qui augmente sa surface et sa réactivité chimique.
Applications courantes et leurs produits
Production de chaux pour le ciment
L'exemple le plus emblématique est la production de chaux à partir de calcaire. Le produit solide, la chaux (oxyde de calcium), est un composant fondamental du ciment et est également utilisé dans la fabrication de l'acier et la production chimique.
Raffinage des minerais métalliques
La calcination est une étape vitale en métallurgie. Les minerais comme le carbonate de zinc (smithsonite) ou le carbonate de plomb (cérusite) sont chauffés pour les convertir en leurs oxydes respectifs.
Ces oxydes métalliques sont le produit souhaité car ils sont beaucoup plus faciles à réduire (fondre) en métal pur dans une étape ultérieure.
Comprendre la distinction clé : Calcination vs Frittage
Calcination : Un processus de soustraction
La calcination est un processus soustractif. Elle retire de la masse du matériau sous forme de gaz.
Son objectif principal est le changement chimique : purifier un matériau ou le convertir en un intermédiaire chimique plus utile. Le solide résultant est souvent plus poreux et physiquement plus faible.
Frittage : Un processus de consolidation
Le frittage, en revanche, est un processus de consolidation. Il utilise la chaleur pour souder ou fusionner de petites particules ensemble, augmentant ainsi la densité et la résistance du matériau.
Aucun changement chimique significatif ne se produit et aucune masse n'est perdue. L'objectif est de transformer une poudre en une pièce solide et cohésive, comme indiqué dans la référence.
Faire le bon choix pour votre objectif
Le processus que vous choisissez dépend entièrement de ce que vous attendez du matériau final.
- Si votre objectif principal est de purifier un minerai ou de créer un intermédiaire chimique comme la chaux : Vous envisagez la calcination, où le produit clé est l'oxyde solide restant après l'élimination des gaz volatils.
- Si votre objectif principal est de créer une pièce finale solide et dense à partir d'une poudre : Vous envisagez le frittage, où le produit est une masse solide formée par la fusion des particules sans changement chimique.
En fin de compte, comprendre si vous devez décomposer un matériau ou le consolider est la clé pour sélectionner le processus thermique correct.

Tableau récapitulatif :
| Type de produit | Description | Exemples courants |
|---|---|---|
| Produit solide | Le principal résultat souhaité ; un oxyde purifié, poreux et réactif. | Chaux (CaO) à partir de calcaire (CaCO₃), oxydes métalliques à partir de minerais. |
| Sous-produit gazeux | Composants volatils expulsés par la chaleur lors de la décomposition. | Dioxyde de carbone (CO₂), vapeur d'eau (H₂O). |
Besoin d'un équipement de traitement thermique précis pour vos projets de calcination ou de frittage ? KINTEK est spécialisé dans les fours de laboratoire haute performance et les systèmes de traitement thermique conçus pour la fiabilité et un contrôle précis de la température. Que vous raffiniez des minerais, produisiez du ciment ou développiez de nouveaux matériaux, nos équipements garantissent des résultats constants et de haute qualité. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour les besoins de votre laboratoire !
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
- Four à moufle de 1800℃ pour laboratoire
Les gens demandent aussi
- Quels sont le temps et la température pour la pyrolyse ? Paramètres de contrôle pour cibler votre produit désiré
- La pyrolyse du plastique est-elle économe en énergie ? Atteindre un bilan énergétique net positif grâce à une conception intelligente
- Quelle est la différence entre la pyrolyse, la combustion et la gazéification ? Un guide des technologies de conversion thermique
- Quelle est l'utilité du biochar issu de la pyrolyse ? Libérez son potentiel en tant que combustible, matériau et amendement du sol
- Comment le temps affecte-t-il la pyrolyse ? Maîtriser le temps de séjour pour contrôler les rendements en biochar, bio-huile et syngaz
- Quels sont les avantages et les inconvénients du four rotatif ? Maximiser l'uniformité et l'efficacité du traitement thermique
- La calcination est-elle effectuée dans le haut fourneau ? Comprendre la séparation en métallurgie
- Quel est un exemple de réaction de pyrolyse ? Découvrez le processus de transformation du bois en charbon de bois



















