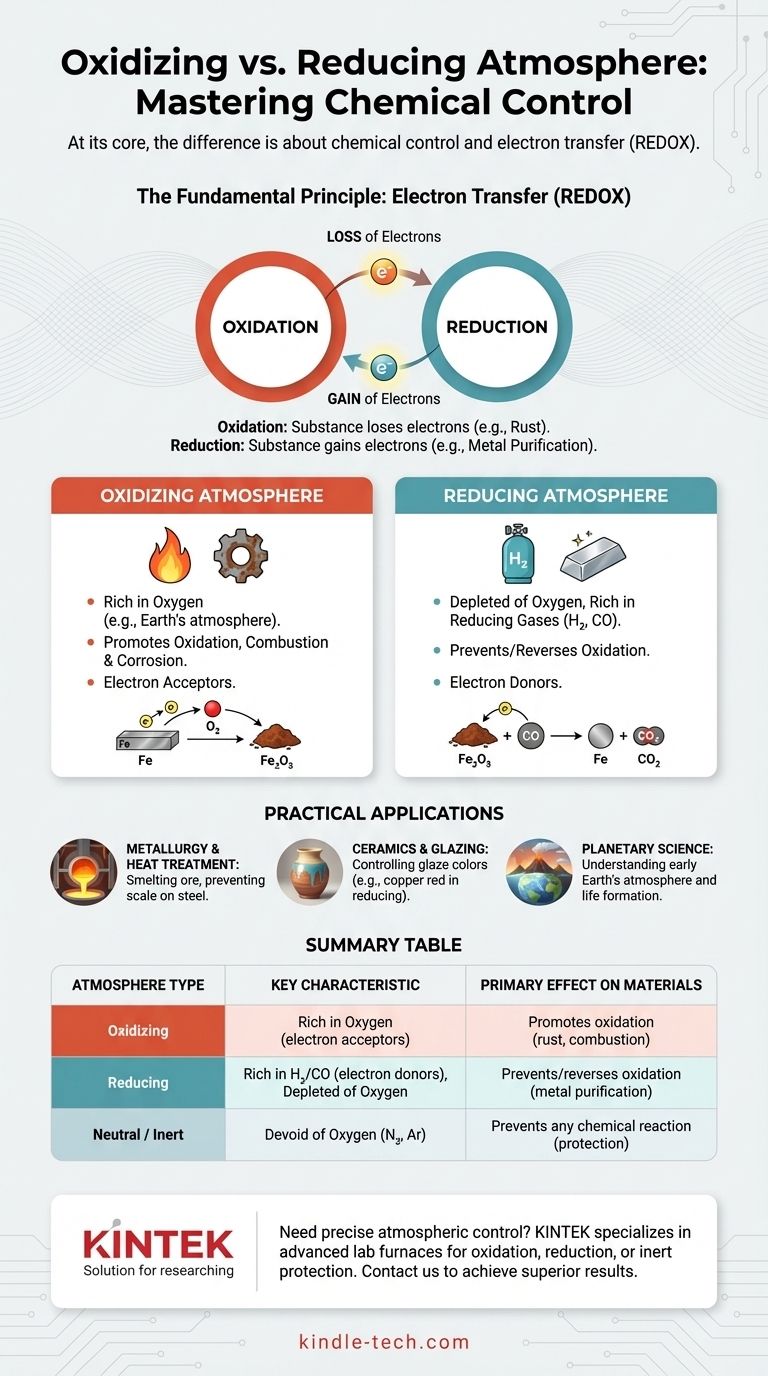
À la base, la différence réside dans le contrôle chimique. Une atmosphère oxydante est riche en oxygène ou en d'autres substances qui acceptent des électrons, favorisant des réactions telles que la combustion et la corrosion. En contraste direct, une atmosphère réductrice est intentionnellement appauvrie en oxygène et contient souvent des gaz comme l'hydrogène ou le monoxyde de carbone qui donnent des électrons, ce qui empêche ou inverse même l'oxydation.
La distinction clé n'est pas seulement la présence d'oxygène, mais si la chimie de l'atmosphère amène un matériau à perdre des électrons (oxydation) ou à gagner des électrons (réduction). Choisir la bonne atmosphère est fondamental pour contrôler le résultat des processus à haute température, de la fabrication de l'acier à la cuisson de poteries artistiques.

Le principe fondamental : le transfert d'électrons
Pour vraiment comprendre la différence, vous devez regarder au-delà des gaz et vous concentrer sur la chimie sous-jacente de l'échange d'électrons. C'est ce qu'on appelle le REDOX (Réduction-Oxydation).
Comprendre l'oxydation : la perte d'électrons
L'oxydation est un processus chimique où une substance perd des électrons. Bien que l'oxygène soit l'agent oxydant le plus connu, il n'est pas le seul.
L'exemple classique est la rouille. Lorsque le fer est exposé à une atmosphère riche en oxygène, les atomes de fer perdent des électrons au profit des atomes d'oxygène, formant de l'oxyde de fer. Le matériau a été oxydé.
Comprendre la réduction : le gain d'électrons
La réduction est le processus exactement opposé : une substance gagne des électrons. Cela « réduit » son état d'oxydation.
Dans une atmosphère réductrice, des gaz comme l'hydrogène (H₂) ou le monoxyde de carbone (CO) sont présents. Ces gaz sont des donneurs d'électrons ; ils donnent facilement leurs électrons à d'autres substances, inversant le processus d'oxydation.
Caractéristiques de chaque environnement
La composition de l'atmosphère dicte directement son comportement chimique et son effet sur les matériaux qu'elle contient.
L'atmosphère oxydante
Un environnement oxydant est caractérisé par une abondance d'oxygène libre ou d'autres agents oxydants. L'atmosphère terrestre en est l'exemple le plus courant.
Cet environnement favorise et accélère la combustion. Il est également le principal moteur de la corrosion et de la dégradation de nombreux matériaux, en particulier les métaux à haute température.
L'atmosphère réductrice
Une atmosphère réductrice est définie par l'absence quasi totale d'oxygène. Pour être activement « réductrice », elle doit également contenir des gaz réducteurs.
Ces gaz, tels que l'hydrogène ou le monoxyde de carbone, vont chimiquement arracher les atomes d'oxygène des matériaux avec lesquels ils entrent en contact. Ceci est essentiel pour des processus tels que la fonte du minerai en métal pur.
L'atmosphère neutre (ou inerte)
Il est important de reconnaître un troisième état : une atmosphère neutre ou inerte. Cet environnement, généralement composé d'azote ou d'argon, est également dépourvu d'oxygène.
Cependant, contrairement à une atmosphère réductrice, ces gaz ne donnent pas activement d'électrons. Leur objectif est simplement de déplacer l'oxygène et d'empêcher toute réaction chimique de se produire, protégeant ainsi le matériau sans le modifier.
Implications pratiques et pourquoi c'est important
Le choix entre ces atmosphères n'est pas académique ; c'est une décision critique dans d'innombrables processus industriels et scientifiques.
En métallurgie et traitement thermique
Lors de la fonte du minerai de fer, un haut fourneau est rempli de coke (une forme de carbone), qui brûle pour créer une atmosphère réductrice riche en monoxyde de carbone et pauvre en oxygène. Le CO arrache l'oxygène du minerai d'oxyde de fer, le réduisant en fer liquide pur.
De même, lors du traitement thermique de l'acier, une atmosphère réductrice est utilisée pour empêcher la formation de « calamine » (une couche d'oxyde de fer) sur la surface chaude du métal.
En céramique et émaillage
L'atmosphère à l'intérieur d'un four a un effet profond sur la couleur finale des émaux de poterie.
Un émail à base de carbonate de cuivre, par exemple, deviendra vert dans une atmosphère oxydante. Dans une atmosphère réductrice, le même émail produira un rouge brillant car l'oxyde de cuivre est chimiquement « réduit » en cuivre pur.
En science planétaire
La distinction est également cruciale pour comprendre la formation planétaire. La Terre primitive avait une atmosphère réductrice, ce qui était une condition nécessaire à la formation des molécules organiques complexes qui ont conduit à la vie.
Ce n'est qu'après l'évolution des organismes photosynthétiques que notre planète a développé l'atmosphère riche en oxygène et oxydante dont nous dépendons aujourd'hui.
Faire le bon choix pour votre objectif
Votre choix est dicté entièrement par la transformation chimique que vous devez réaliser.
- Si votre objectif principal est d'empêcher la corrosion ou d'éliminer l'oxygène d'un composé (comme la fonte de minerai) : Vous avez besoin d'une atmosphère réductrice riche en agents tels que le monoxyde de carbone ou l'hydrogène.
- Si votre objectif principal est la combustion complète ou la création d'un oxyde chimique spécifique : Vous avez besoin d'une atmosphère oxydante avec un apport contrôlé en oxygène.
- Si votre objectif principal est simplement de protéger un matériau de tout changement chimique à haute température : Vous devriez utiliser une atmosphère neutre ou inerte, telle que de l'argon ou de l'azote pur.
En fin de compte, maîtriser les conditions atmosphériques signifie que vous maîtrisez l'état final et l'intégrité de votre matériau.
Tableau récapitulatif :
| Type d'atmosphère | Caractéristique clé | Effet principal sur les matériaux | Applications courantes |
|---|---|---|---|
| Oxydante | Riche en oxygène (accepteurs d'électrons) | Favorise l'oxydation (ex. : rouille, combustion) | Combustion complète, création d'oxydes spécifiques |
| Réductrice | Appauvrie en oxygène, riche en H₂/CO (donneurs d'électrons) | Prévient/inverse l'oxydation (ex. : purification des métaux) | Fonte du minerai, prévention de la calamine sur l'acier, effets de couleur sur la céramique |
| Neutre/Inerte | Dépourvue d'oxygène (ex. : N₂, Ar) | Prévient toute réaction chimique | Protection des matériaux contre les changements à haute température |
Besoin d'un contrôle atmosphérique précis pour vos processus de laboratoire ? La bonne atmosphère de four est essentielle pour obtenir les propriétés matérielles souhaitées, que vous traitiez thermiquement des métaux, développiez de nouvelles céramiques ou protégiez des échantillons sensibles. KINTEK se spécialise dans les fours de laboratoire avancés et les équipements conçus pour un contrôle atmosphérique exact. Nos experts peuvent vous aider à choisir la solution parfaite pour assurer une protection oxydante, réductrice ou inerte pour votre application spécifique. Contactez KINTEK dès aujourd'hui pour discuter de vos besoins en laboratoire et obtenir des résultats supérieurs.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four de laboratoire tubulaire vertical
- Four à atmosphère d'hydrogène contrôlée à l'azote
Les gens demandent aussi
- Pourquoi un four d'oxydation à la vapeur à haute température est-il essentiel pour les tests de performance des gaines de combustible revêtues de chrome ?
- Quels sont les rôles du frittage par gravité et de l'argon dans les supports NiCoCrAlY ? Guide expert de la fabrication d'alliages poreux
- Qu'est-ce que le traitement thermique sous atmosphère d'azote ? Un guide pour un traitement des métaux contrôlé et de haute qualité
- Pourquoi un four à atmosphère est-il requis pour les catalyseurs acides solides à base de carbone ? Maîtriser la carbonisation incomplète
- Qu'est-ce qu'un système de traitement thermique à atmosphère contrôlée ? Maîtriser le traitement thermique de précision
- Quelle est la fonction de l'atmosphère inerte dans le frittage du nickel-alumine ? Obtenir une liaison composite de haute pureté
- Quels sont les trois types fonctionnels d'atmosphères commerciales à base d'azote ? Maîtrisez la chimie de votre traitement thermique
- Pourquoi utiliser un four à atmosphère contrôlée de précision pour le recuit des HEA ? Débloquez des données de stabilité de matériaux purs



















