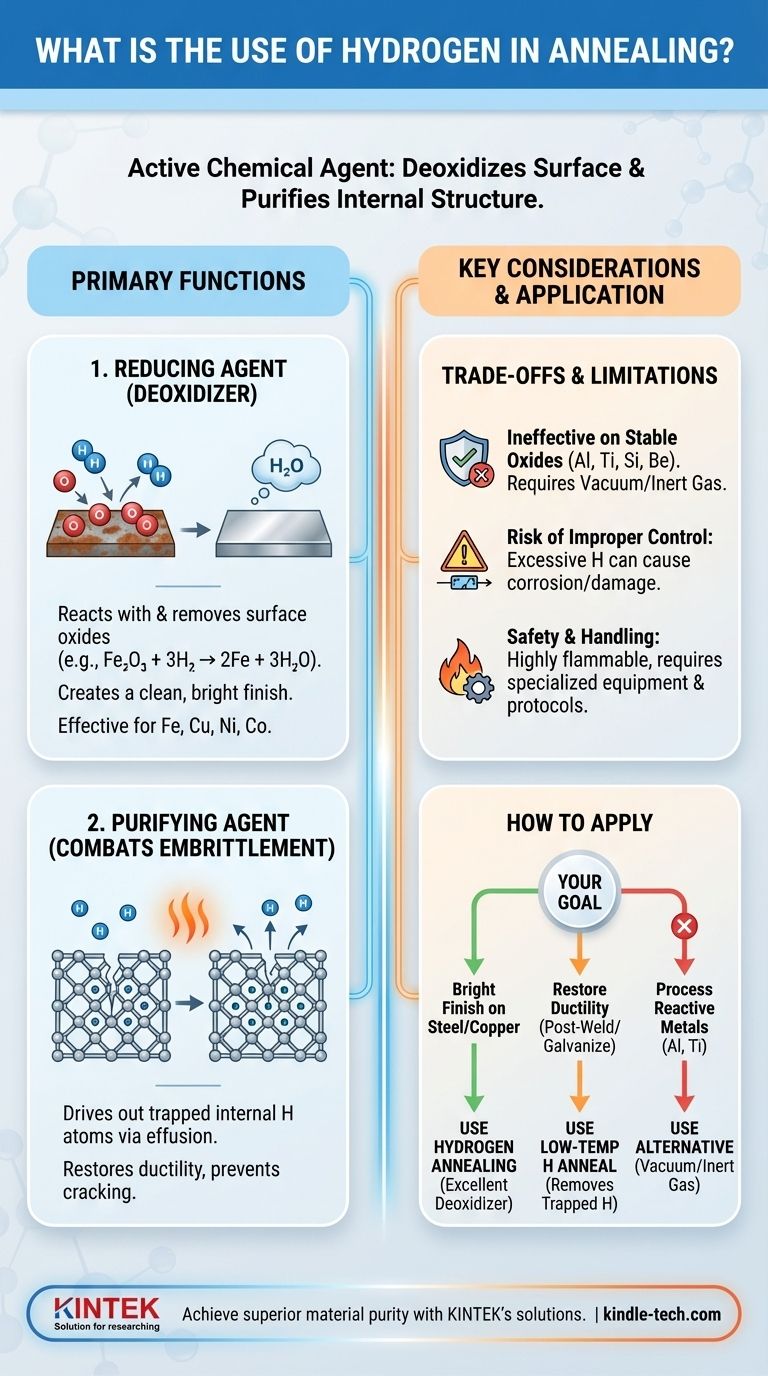
En bref, l'hydrogène est utilisé dans le recuit comme agent chimique actif. Il remplit deux fonctions principales : éliminer les oxydes de surface pour obtenir une finition propre et brillante, et extraire les atomes d'hydrogène internes piégés qui peuvent provoquer la fragilisation du matériau.
L'objectif fondamental de l'utilisation de l'hydrogène dans le recuit est de transformer le processus d'un simple chauffage en un affinage chimique ciblé. Il purifie activement le matériau en désoxydant sa surface et en éliminant les contaminants internes, prévenant ainsi les défaillances critiques telles que la fragilisation.

Les fonctions principales de l'hydrogène dans le recuit
Le recuit est un processus de traitement thermique conçu pour soulager les contraintes internes et améliorer la ductilité d'un matériau. L'introduction d'hydrogène dans l'atmosphère du four ajoute une puissante composante chimique à ce processus physique.
Comme agent réducteur (désoxydant)
De nombreux métaux, en particulier le fer, le cuivre et le nickel, forment des oxydes à leur surface lorsqu'ils sont exposés à l'air. Ces couches d'oxyde peuvent nuire à la qualité et à l'apparence du produit final.
L'hydrogène agit comme un agent réducteur, ce qui signifie qu'il réagit chimiquement avec ces oxydes et les élimine. Aux températures élevées du four de recuit, l'hydrogène se lie aux atomes d'oxygène de l'oxyde métallique, formant de la vapeur d'eau (H₂O) qui est ensuite évacuée. Il en résulte une surface métallique pure, propre et brillante.
Comme agent de purification pour combattre la fragilisation
Certains processus de fabrication tels que le soudage, la galvanoplastie ou la galvanisation peuvent introduire de l'hydrogène atomique dans la structure interne du métal. Ces atomes piégés peuvent provoquer un état grave connu sous le nom de fragilisation par l'hydrogène.
La fragilisation par l'hydrogène réduit considérablement la ductilité du métal, le rendant cassant et sujet à la fissuration sous contrainte. Le recuit dans une atmosphère riche en hydrogène aide à inverser ce phénomène. Le processus, connu sous le nom d'effusion, utilise la chaleur pour donner aux atomes d'hydrogène piégés l'énergie nécessaire pour diffuser hors du matériau, restaurant ainsi son intégrité.
Les mécanismes chimiques en jeu
Comprendre comment l'hydrogène accomplit ces tâches nécessite d'examiner les réactions entraînées par l'énergie thermique du processus de recuit.
La réaction de désoxydation
La réaction fondamentale pour éliminer un oxyde, tel que l'oxyde de fer (rouille), est simple. Le gaz hydrogène (H₂) réagit avec l'oxyde métallique pour produire le métal pur et de l'eau.
Pour l'oxyde de fer, la réaction est : Fe₂O₃ + 3H₂ → 2Fe + 3H₂O. Ce processus est très efficace pour les oxydes de fer, de cuivre, de nickel et de cobalt.
Évacuer l'hydrogène piégé
L'élimination de l'hydrogène interne repose sur le principe de la diffusion. En chauffant le matériau dans une atmosphère d'hydrogène, les atomes d'hydrogène piégés acquièrent suffisamment d'énergie thermique pour se déplacer à travers le réseau cristallin du métal.
Ils migrent vers la surface, où ils peuvent s'échapper, purgant ainsi efficacement le matériau du contaminant qui provoque la fragilisation. Ceci est le plus souvent effectué à des températures comprises entre 200 °C et 300 °C.
Comprendre les compromis et les limites
Bien que puissant, le recuit à l'hydrogène n'est pas une solution universelle. Son efficacité dépend du matériau et du contrôle précis du processus.
Inefficacité sur les oxydes stables
L'hydrogène n'est pas assez puissant pour réduire les oxydes très stables formés par certains métaux. Les oxydes de matériaux tels que l'aluminium, le titane, le silicium et le béryllium ne réagissent pas avec l'hydrogène dans les conditions de recuit typiques.
Pour ces matériaux, des méthodes alternatives telles que le recuit sous vide ou dans une atmosphère de gaz inerte (comme l'argon) sont nécessaires.
Le risque d'un contrôle inapproprié
La concentration et le débit de l'hydrogène sont des variables critiques. Comme on le voit dans la synthèse de matériaux avancés comme la production de graphène, l'hydrogène est utilisé pour éliminer le carbone amorphe indésirable.
Cependant, un excès d'hydrogène peut commencer à corroder et à endommager le matériau souhaité lui-même. Ce principe s'applique également au recuit des métaux ; le processus doit être soigneusement optimisé pour purifier sans causer de dommages.
Sécurité et manipulation
En tant que gaz hautement inflammable, l'hydrogène nécessite des équipements spécialisés et des protocoles de sécurité stricts. Cette complexité opérationnelle et ce coût sont une considération importante lors du choix d'une atmosphère de recuit.
Comment appliquer cela à votre objectif
La décision d'utiliser le recuit à l'hydrogène dépend entièrement du matériau avec lequel vous travaillez et du résultat souhaité.
- Si votre objectif principal est une finition brillante et sans oxyde sur des pièces en acier ou en cuivre : Le recuit à l'hydrogène est un excellent choix pour ses propriétés désoxydantes efficaces.
- Si votre objectif principal est de restaurer la ductilité après soudage ou galvanisation : Un recuit à l'hydrogène à basse température est le remède spécifique pour éliminer l'hydrogène piégé et prévenir la fragilisation.
- Si votre objectif principal est le traitement de l'aluminium, du titane ou d'autres métaux réactifs : Vous devez utiliser une alternative comme le recuit sous vide ou sous gaz inerte, car l'hydrogène ne réduira pas leurs oxydes stables.
En fin de compte, l'utilisation correcte de l'hydrogène fait passer le recuit d'un simple traitement thermique à un processus de purification chimique précis.
Tableau récapitulatif :
| Fonction | Mécanisme | Avantage clé |
|---|---|---|
| Agent réducteur | Réagit avec les oxydes de surface (ex. Fe₂O₃) pour former de la vapeur d'eau. | Crée une finition brillante et sans oxyde. |
| Agent de purification | La chaleur chasse les atomes d'hydrogène internes piégés hors du métal (effusion). | Prévient la fragilisation par l'hydrogène, restaure la ductilité. |
Obtenez une pureté et des performances de matériaux supérieures avec les solutions de recuit à l'hydrogène de KINTEK.
Nos équipements de laboratoire spécialisés sont conçus pour un contrôle précis de l'atmosphère d'hydrogène, assurant une désoxydation et une élimination de l'hydrogène efficaces pour des métaux comme l'acier, le cuivre et le nickel. Cela prévient la fragilisation et offre la finition propre et brillante que votre application exige.
Contactez-nous dès aujourd'hui pour discuter de la manière dont nos systèmes de recuit peuvent améliorer les capacités de votre laboratoire et la qualité de vos matériaux.
Prenez contact avec nos experts →
Guide Visuel
Produits associés
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four de laboratoire tubulaire vertical
Les gens demandent aussi
- Pourquoi l'hydrogène gazeux est-il utilisé dans les fours de recuit ? Pour une pureté de surface supérieure et des cycles plus rapides
- Comment un four à moufle atmosphérique contribue-t-il au processus de calcination ? Transformation de la structure spinelle maîtresse
- L'hydrogène peut-il être utilisé dans les fours ? Oui, pour le traitement des métaux sans oxydation et le chauffage rapide
- Comment un four à atmosphère contrôlée garantit-il la qualité de la synthèse des nanotubes de BN ? Contrôle de précision pour les structures en gobelet empilé
- Quels sont les différents types d'atmosphères préparées à base d'azote ? Choisissez Lean ou Rich pour un traitement thermique optimal
- Comment l'argon pur à haut débit assure-t-il la protection lors du recuit de Cr-Al-C ? Assurer une intégrité supérieure de la phase MAX
- Quel rôle joue un four de frittage sous atmosphère dans le co-frittage du NMC622 et du LLZ ? Atteindre des interfaces de haute performance
- Quel est le gaz inerte le plus courant dans l'atmosphère ? Découvrez le rôle de l'argon



















