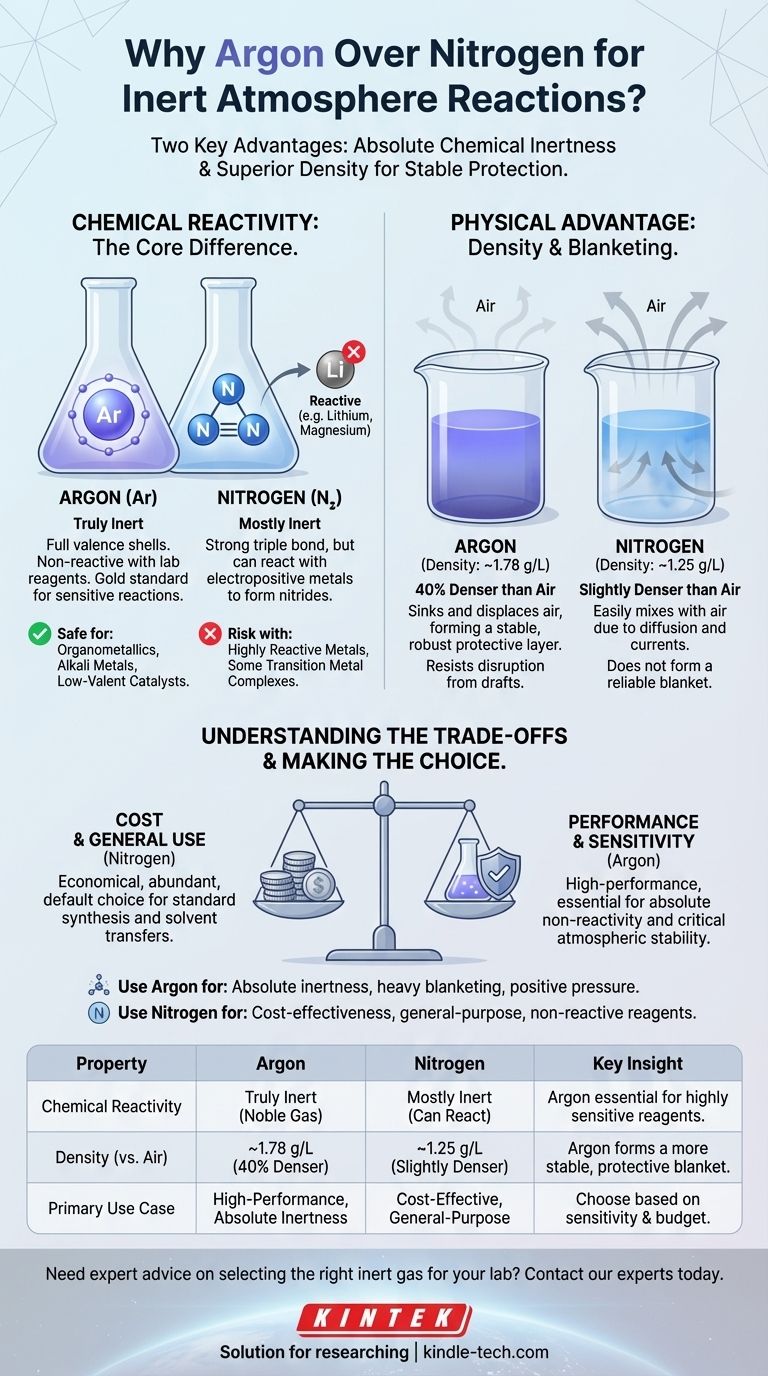
En pratique, l'argon est souvent considéré comme « meilleur » que l'azote pour les réactions sous atmosphère inerte en raison de deux propriétés clés. L'argon est un gaz noble véritablement inerte, incapable de réagir avec les réactifs de laboratoire, tandis que l'azote peut réagir dans certaines conditions. De plus, la densité plus élevée de l'argon lui permet de former un « voile » plus stable et protecteur au-dessus d'une réaction, déplaçant plus efficacement l'air.
Le choix entre l'argon et l'azote ne dépend pas de celui qui est universellement meilleur, mais de celui qui est le plus approprié pour une tâche spécifique. L'azote est le cheval de bataille économique pour l'inertage à usage général, tandis que l'argon est l'option haute performance pour les réactions exigeant une non-réactivité absolue et une stabilité atmosphérique.

La différence fondamentale : la réactivité chimique
La raison la plus fondamentale de choisir un gaz plutôt qu'un autre réside dans son potentiel à participer à votre réaction.
Argon : La définition de l'inertie
L'argon est un gaz noble. Ses couches d'électrons de valence sont entièrement remplies, ce qui le rend exceptionnellement stable et non réactif dans pratiquement toutes les conditions de laboratoire.
Pour un chimiste, c'est la référence absolue. Vous pouvez être certain que l'argon n'interférera pas avec votre réaction, aussi sensibles que soient les réactifs.
Azote : « Principalement » inerte
Le gaz diazote (N₂) est composé de deux atomes d'azote unis par une très forte triple liaison. Cette liaison nécessite beaucoup d'énergie pour être rompue, c'est pourquoi le N₂ est principalement inerte et convient à de nombreuses applications.
Cependant, il n'est pas complètement inerte. Les réactifs très réactifs, en particulier les métaux électropositifs comme le lithium, le magnésium et certains complexes de métaux de transition, peuvent réagir avec le N₂ pour former des nitrures métalliques. Cette réaction secondaire indésirable peut réduire votre rendement ou introduire des impuretés.
L'avantage physique : la densité
Au-delà de la réactivité chimique, le comportement physique du gaz en laboratoire est un facteur critique. L'air est un mélange de gaz, mais il a une densité moyenne à laquelle nous pouvons comparer.
- Densité de l'argon : ~1,78 g/L
- Densité de l'air : ~1,23 g/L
- Densité de l'azote : ~1,25 g/L
Comment la densité crée un « voile » protecteur
L'argon est environ 40 % plus dense que l'air. Lorsque vous purgez un flacon avec de l'argon, il s'enfonce efficacement et déplace l'air plus léger, le poussant vers le haut et vers l'extérieur. Il se dépose ensuite sur votre mélange réactionnel, formant un voile stable et lourd qui résiste aux perturbations.
L'azote, en revanche, n'est que légèrement plus dense que l'air. Il est beaucoup plus susceptible de se mélanger à l'air en raison de la diffusion et des légers courants d'air ou des courants de convection dans la pièce. Il ne forme pas la même couche protectrice robuste.
Implications pratiques pour les configurations de laboratoire
Cette différence de densité a des conséquences réelles. Dans une boîte à gants ou sur une ligne Schlenk, une pression positive d'argon offre une atmosphère plus tolérante. En cas de fuite mineure, l'argon dense s'écoulera préférentiellement, empêchant l'air plus léger d'entrer.
Pour les techniques qui reposent sur le recouvrement d'un récipient ouvert, comme dans de nombreuses expériences électrochimiques, l'argon est largement supérieur car il restera déposé sur la solution. L'azote se mélangerait simplement à l'air ambiant presque immédiatement.
Comprendre les compromis
Choisir le gaz idéal nécessite d'équilibrer la performance par rapport aux contraintes pratiques.
Coût : Le facteur décisif pour beaucoup
L'azote représente environ 78 % de l'atmosphère terrestre, tandis que l'argon représente moins de 1 %. Cette différence d'abondance rend l'azote nettement moins cher à produire et à acheter.
Pour les procédés industriels à grande échelle ou les procédures de laboratoire de routine où une inertie extrême n'est pas nécessaire, les économies réalisées en utilisant l'azote sont substantielles et en font souvent le choix par défaut.
Réactivité : Quand « principalement » inerte suffit
La réactivité potentielle de l'azote n'a d'importance que si votre système chimique est capable de rompre cette triple liaison N≡N.
Pour la grande majorité des réactions organiques, des purifications et des transferts de solvants, l'azote est parfaitement adéquat. Les réactifs ne sont tout simplement pas assez réactifs pour former des nitrures, rendant l'argon une dépense inutile.
Faire le bon choix pour votre réaction
Basez votre décision sur les exigences spécifiques de votre procédé chimique et les réalités pratiques de votre laboratoire.
- Si votre objectif principal est une inertie absolue pour les réactifs sensibles : Utilisez l'argon lorsque vous travaillez avec des organométalliques (en particulier ceux impliquant Li, Mg), des métaux alcalins, des catalyseurs à base de métaux de transition de basse valence, ou tout système où la formation de nitrure est un risque connu.
- Si votre objectif principal est la rentabilité et l'utilisation générale : Utilisez l'azote pour la plupart des synthèses organiques standard, les distillations de solvants, les recristallisations et autres procédures n'impliquant pas d'espèces exceptionnellement réactives.
- Si votre objectif principal est de maintenir une atmosphère stable : Utilisez l'argon pour les techniques nécessitant un voile de gaz lourd, comme l'électrochimie, ou dans les configurations où le maintien d'une pression positive contre les fuites potentielles est essentiel.
En fin de compte, comprendre les propriétés chimiques et physiques distinctes de chaque gaz vous permet de faire le choix le plus éclairé et le plus économique pour votre expérience.
Tableau récapitulatif :
| Propriété | Argon | Azote | Idée clé |
|---|---|---|---|
| Réactivité chimique | Véritablement inerte (gaz noble) | Principalement inerte, mais peut réagir avec les métaux électropositifs | L'argon est essentiel pour les réactifs très sensibles. |
| Densité (par rapport à l'air) | ~1,78 g/L (40 % plus dense) | ~1,25 g/L (légèrement plus dense) | L'argon forme un voile protecteur plus stable. |
| Cas d'utilisation principal | Réactions haute performance exigeant une inertie absolue | Solution économique pour l'inertage à usage général | Choisissez en fonction de la sensibilité de votre réaction et de votre budget. |
Besoin de conseils d'experts sur le choix du gaz inerte adapté à votre application de laboratoire spécifique ?
KINTEK est spécialisée dans la fourniture de gaz de laboratoire de haute pureté et d'équipements, y compris des systèmes à argon et à azote, pour garantir que vos réactions sensibles soient parfaitement protégées. Notre équipe peut vous aider à optimiser votre installation pour un rendement et une sécurité maximales.
Contactez nos experts dès aujourd'hui pour discuter de vos besoins en atmosphère inerte et trouver la solution la plus efficace pour votre laboratoire.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quel est le but du maintien d'un flux continu d'argon ? Optimiser la récupération du PLAP avec de l'aluminium de haute pureté
- Pourquoi l'azote est-il utilisé dans le processus de recuit ? Empêcher l'oxydation pour une finition métallique parfaite
- Que signifie avoir une atmosphère oxydante par rapport à une atmosphère réductrice ? Maîtriser le contrôle chimique de vos matériaux
- Quel est le but principal de l'utilisation d'atmosphères dans le traitement thermique ? Protéger les surfaces et améliorer la qualité du métal
- Quels sont les effets des gaz inertes ? Découverte de leurs risques cachés et de leurs utilisations industrielles
- Pourquoi une atmosphère inerte est-elle importante ? Prévenir l'oxydation, les incendies et la contamination
- Pourquoi un four à atmosphère d'hydrogène est-il nécessaire pour le composite W-Cu ? Obtenez une infiltration et une densité supérieures
- À quoi sert un four à cornue ? Contrôle précis de l'atmosphère pour le durcissement superficiel



















