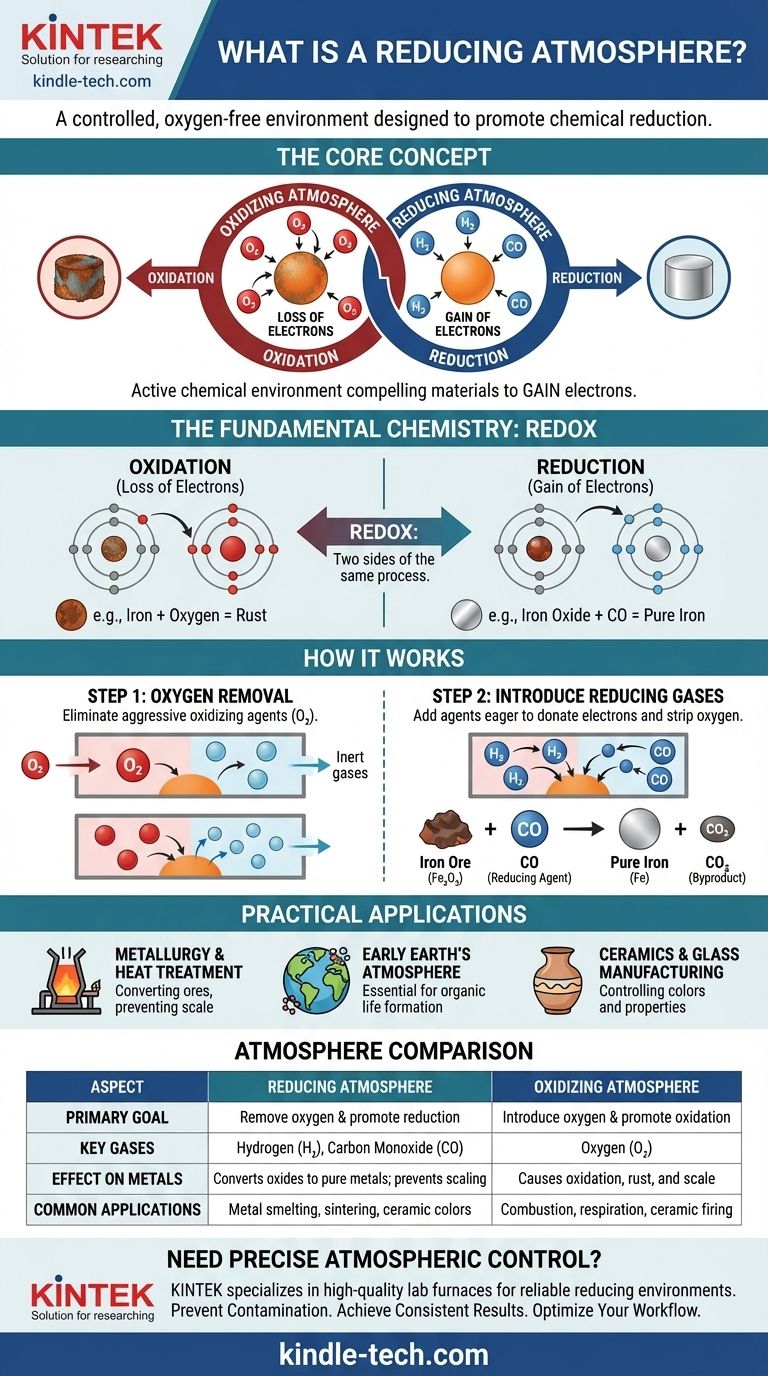
En bref, une atmosphère réductrice est un environnement gazeux contrôlé où l'oxygène a été intentionnellement retiré et remplacé par des gaz qui empêchent l'oxydation et favorisent activement la réduction chimique. Ce type d'atmosphère est riche en « agents réducteurs » tels que l'hydrogène (H₂), le monoxyde de carbone (CO) ou le sulfure d'hydrogène (H₂S), qui sont chimiquement désireux de céder des électrons et d'arracher l'oxygène à d'autres matériaux.
Une atmosphère réductrice ne consiste pas simplement en l'absence d'oxygène ; c'est un environnement chimique actif conçu pour forcer une réaction spécifique. Elle fonctionne en créant un surplus d'électrons, obligeant les matériaux qu'elle contient à gagner ces électrons et à revenir à un état moins oxydé.

La chimie fondamentale en jeu
Pour vraiment comprendre une atmosphère réductrice, vous devez d'abord comprendre le principe chimique fondamental sur lequel elle est basée : l'oxydation et la réduction. Ce sont deux faces de la même pièce, un processus souvent appelé « rédox ».
Comprendre l'oxydation et la réduction
L'oxydation est la perte d'électrons. Un exemple classique est la rouille du fer. L'oxygène dans l'air arrache des électrons aux atomes de fer, formant de l'oxyde de fer (rouille). Le fer est « oxydé ».
La réduction est le gain d'électrons. C'est l'opposé chimique de l'oxydation. Une atmosphère réductrice facilite ce processus en créant un environnement où les atomes sont forcés d'accepter des électrons.
Considérez cela comme une guerre de tir à la corde chimique pour les électrons. Un agent oxydant, comme l'oxygène, est fort et arrache des électrons aux autres matériaux. Un agent réducteur, comme l'hydrogène, est généreux et donne des électrons à d'autres matériaux.
Le rôle de l'élimination de l'oxygène
La première et la plus critique étape dans la création d'une atmosphère réductrice est l'élimination de l'oxygène libre (O₂) et des autres gaz oxydants.
L'oxygène est un agent oxydant très agressif. Sa présence rend presque impossible la réalisation d'une réaction de réduction, car il arrachera sans relâche des électrons à toute source disponible. L'éliminer empêche cette oxydation indésirable de se produire.
La fonction des gaz réducteurs
Le simple fait d'éliminer l'oxygène crée une atmosphère neutre, ou inerte. Pour en faire une atmosphère réductrice, des gaz spécifiques sont introduits.
Ces gaz — typiquement l'hydrogène (H₂) ou le monoxyde de carbone (CO) — agissent comme de puissants agents réducteurs. Ils ont une affinité plus forte pour l'oxygène que de nombreux autres éléments, ce qui signifie qu'ils « volent » activement des atomes d'oxygène aux composés comme les oxydes métalliques.
Par exemple, lorsque du minerai de fer (oxyde de fer, Fe₂O₃) est chauffé dans un four avec du monoxyde de carbone, le CO arrache l'oxygène au fer, laissant derrière lui du fer liquide pur et créant du dioxyde de carbone (CO₂) comme sous-produit. Le minerai de fer a été « réduit » en fer.
Applications pratiques et contexte
Les atmosphères réductrices ne sont pas seulement un concept théorique ; elles sont un outil essentiel dans de nombreux processus industriels et scientifiques où un contrôle chimique précis est nécessaire.
Métallurgie et traitement thermique
C'est l'application la plus courante. Les hauts fourneaux utilisent une atmosphère réductrice riche en monoxyde de carbone pour transformer les minerais métalliques en métaux purs. Elle est également utilisée dans le recuit et le frittage pour empêcher la formation d'oxydes (calamine) à la surface des métaux lors des traitements à haute température.
L'atmosphère de la Terre primitive
Les scientifiques théorisent que l'atmosphère primordiale de la Terre était réductrice, contenant du méthane, de l'ammoniac et de la vapeur d'eau, mais pratiquement pas d'oxygène libre. Cet environnement était essentiel à la formation des molécules organiques complexes qui ont finalement conduit à la vie.
Fabrication de céramiques et de verre
L'atmosphère à l'intérieur d'un four a un effet profond sur le produit final. Une atmosphère réductrice peut être utilisée pour créer des couleurs et des propriétés spécifiques dans les glaçures céramiques et le verre en modifiant l'état d'oxydation des oxydes métalliques utilisés comme colorants. Par exemple, l'oxyde de cuivre produit du vert dans un feu oxydant mais un rouge profond dans un feu réducteur.
Comprendre les compromis : Oxydant contre Réducteur
L'opposé d'une atmosphère réductrice est une atmosphère oxydante, riche en oxygène. L'atmosphère actuelle de notre planète en est un exemple parfait.
L'atmosphère oxydante
Une atmosphère oxydante favorise la perte d'électrons. Elle est essentielle pour des processus tels que la combustion (brûlage) et la respiration cellulaire, mais elle est destructrice dans d'autres contextes, provoquant la corrosion, la détérioration et la dégradation.
Pourquoi le contrôle atmosphérique est essentiel
Le choix entre une atmosphère réductrice, inerte ou oxydante est entièrement déterminé par le résultat souhaité. Utiliser la mauvaise atmosphère n'est pas seulement inefficace ; cela peut être catastrophique pour un processus.
Tenter de fondre du métal dans un environnement riche en oxygène échouerait, produisant plutôt plus d'oxydes et de calamine. Inversement, cuire une céramique qui nécessite une oxydation dans une atmosphère réductrice entraînerait des couleurs incorrectes et imprévisibles.
Comment appliquer ces connaissances
Comprendre le but d'une atmosphère spécifique revient à identifier la transformation chimique souhaitée.
- Si l'objectif principal est d'empêcher la dégradation : Une atmosphère inerte ou réductrice est utilisée pour éliminer l'oxygène, l'agent principal de la corrosion et de l'oxydation.
- Si l'objectif principal est de transformer un matériau d'un oxyde à sa forme pure : Une atmosphère réductrice est nécessaire pour arracher activement les atomes d'oxygène au matériau (par exemple, transformer le minerai en métal).
- Si l'objectif principal est de contrôler les propriétés finales d'un composé : L'équilibre entre oxydation et réduction est utilisé pour manipuler l'état électronique des éléments, contrôlant ainsi les résultats tels que la couleur dans les céramiques ou la conductivité dans les semi-conducteurs.
En fin de compte, savoir si une atmosphère est conçue pour donner ou accepter des électrons est la clé pour prédire et contrôler les résultats chimiques.
Tableau récapitulatif :
| Aspect | Atmosphère Réductrice | Atmosphère Oxydante |
|---|---|---|
| Objectif Principal | Éliminer l'oxygène et favoriser la réduction (gain d'électrons) | Introduire de l'oxygène et favoriser l'oxydation (perte d'électrons) |
| Gaz Clés | Hydrogène (H₂), Monoxyde de Carbone (CO) | Oxygène (O₂) |
| Effet sur les Métaux | Convertit les oxydes métalliques en métaux purs ; empêche la formation de calamine | Provoque l'oxydation, entraînant rouille et calamine |
| Applications Courantes | Fusion des métaux, recuit, frittage, glaçures céramiques spécifiques | Combustion, respiration, cuisson de certaines céramiques |
Besoin d'un contrôle atmosphérique précis pour vos processus de laboratoire ?
Que vous frittiez des métaux, développiez des glaçures céramiques spécialisées ou meniez des recherches nécessitant un environnement sans oxygène, l'équipement adéquat est essentiel. KINTEK est spécialisé dans la fourniture de fours de laboratoire et de réacteurs de haute qualité conçus pour un contrôle atmosphérique précis, y compris la création d'environnements réducteurs fiables.
Nous vous aidons à :
- Prévenir la Contamination : Assurez-vous que vos matériaux ne sont pas dégradés par une oxydation indésirable.
- Obtenir des Résultats Cohérents : Réalisez les transformations chimiques précises dont vous avez besoin, lot après lot.
- Optimiser Votre Flux de Travail : Grâce à des équipements conçus pour la fiabilité et la facilité d'utilisation.
Prêt à améliorer les capacités de votre laboratoire ? Contactez KINTEK dès aujourd'hui pour discuter de vos besoins spécifiques en laboratoire et de la manière dont nos solutions peuvent favoriser votre succès.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four rotatif à tubes multiples zones chauffantes divisées
Les gens demandent aussi
- Pourquoi l'azote est-il utilisé dans les fours de recuit ? Pour prévenir l'oxydation et la décarburation afin d'obtenir une qualité de métal supérieure
- Quel est un exemple d'atmosphère inerte ? Découvrez le meilleur gaz pour votre procédé
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Quels gaz sont utilisés dans les atmosphères inertes ? Choisissez le bon gaz pour les environnements non réactifs
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir les incendies et les explosions



















