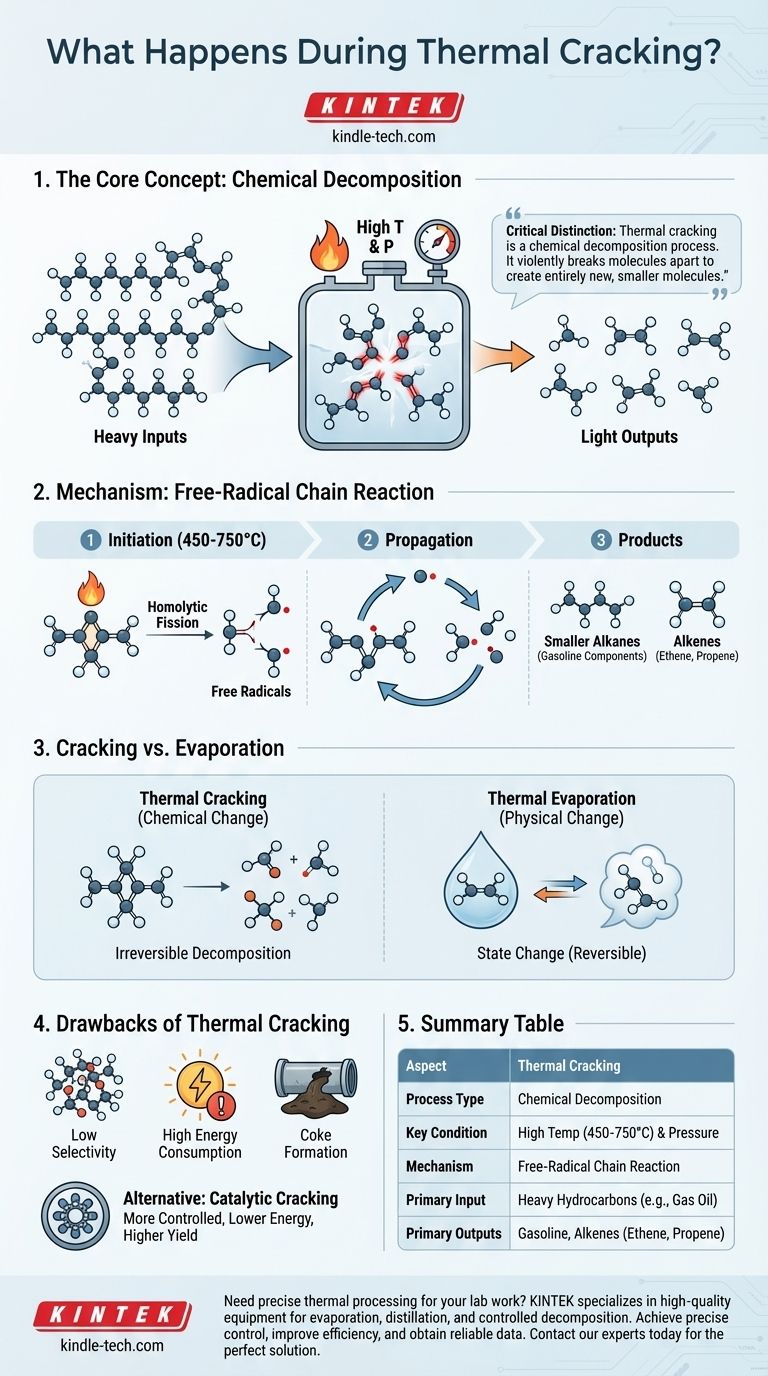
Essentiellement, le craquage thermique est un processus chimique qui utilise des températures et des pressions élevées pour décomposer de grosses molécules d'hydrocarbures complexes en molécules plus petites et plus précieuses. Contrairement à un simple changement de phase comme l'ébullition, ce processus modifie fondamentalement la structure chimique des molécules en rompant leurs liaisons carbone-carbone. Les intrants principaux sont des fractions d'hydrocarbures lourdes et de faible valeur, et les produits sont des produits plus légers et plus utiles comme les composants de l'essence et les alcènes.
La distinction essentielle à comprendre est que le craquage thermique est un processus de décomposition chimique. Il ne se contente pas de changer l'état d'une substance (comme la fusion ou l'ébullition) ; il brise violemment les molécules pour créer de nouvelles molécules plus petites.

Le mécanisme central de la décomposition moléculaire
Le craquage thermique n'est pas un processus doux. Il repose sur la force brute — sous forme d'énergie thermique — pour initier une réaction en chaîne qui pulvérise les hydrocarbures à longue chaîne.
Initiation de la réaction
Le processus commence par le chauffage des charges d'hydrocarbures lourdes, telles que le gazole ou le naphta, à des températures très élevées, généralement comprises entre 450°C et 750°C (842°F et 1382°F), sous haute pression. Cette énergie thermique intense fournit l'énergie d'activation nécessaire pour rompre les fortes liaisons simples carbone-carbone au sein des grosses molécules.
La réaction en chaîne par radicaux libres
La rupture initiale d'une liaison carbone-carbone est appelée clivage homolytique. Cet événement divise la liaison uniformément, créant deux fragments très réactifs, chacun avec un électron non apparié. Ces fragments sont connus sous le nom de radicaux libres.
Ces radicaux libres instables attaquent immédiatement d'autres grosses molécules d'hydrocarbures, propageant une réaction en chaîne qui les décompose en une variété de molécules plus petites et de radicaux libres supplémentaires, poursuivant ainsi le cycle.
Principaux produits formés
Ce processus aboutit à un mélange de produits plus petits et plus précieux. Les produits principaux sont généralement :
- Des alcanes plus petits : Ils sont utilisés pour augmenter le rendement en essence à indice d'octane élevé.
- Des alcènes : Des molécules comme l'éthène (éthylène) et le propène (propylène) sont des blocs de construction cruciaux pour l'industrie pétrochimique, utilisés pour produire des polymères et des plastiques.
Différencier le craquage des autres processus thermiques
Le terme « thermique » peut prêter à confusion, car il s'applique à de nombreux processus scientifiques différents. Comprendre la différence fondamentale entre un changement chimique et un changement physique est essentiel.
Craquage thermique contre évaporation thermique
Le craquage thermique induit un changement chimique. Son objectif est de rompre les liaisons moléculaires et de créer des substances entièrement nouvelles. Il s'agit d'une décomposition irréversible.
L'évaporation thermique, en revanche, est un changement physique. Elle utilise la chaleur pour transformer un solide ou un liquide en vapeur pour des applications telles que le dépôt de couches minces. Les molécules elles-mêmes restent intactes ; elles passent simplement à l'état gazeux.
Craquage catalytique : une alternative plus contrôlée
Les raffineries modernes préfèrent souvent le craquage catalytique. Ce processus réalise la même décomposition moléculaire mais utilise un catalyseur pour abaisser la température et la pression requises. Cela permet un meilleur contrôle de la réaction, conduisant à un rendement plus élevé de produits désirés et à une consommation d'énergie moindre.
Comprendre les compromis et les limites
Bien qu'efficace, le craquage thermique traditionnel présente plusieurs inconvénients majeurs qui ont conduit à l'adoption de méthodes plus avancées.
Manque de sélectivité
Le mécanisme par radicaux libres est difficile à contrôler. Il produit un large mélange d'hydrocarbures, et le rendement du produit spécifique souhaité peut être inférieur à celui des méthodes plus ciblées.
Consommation d'énergie élevée
Atteindre et maintenir les températures et pressions extrêmes requises pour le craquage thermique est un processus très énergivore et coûteux.
Formation de coke
Un effet secondaire courant et problématique est la formation d'un résidu solide, riche en carbone, connu sous le nom de coke. Ce matériau se dépose sur les parois du réacteur, réduisant l'efficacité et nécessitant des arrêts périodiques pour être retiré.
Application pratique
Choisir ou comprendre un processus thermique dépend entièrement de votre objectif — que vous ayez besoin de briser des molécules ou simplement de changer leur état.
- Si votre objectif principal est de produire de l'essence à indice d'octane élevé de manière efficace : Les raffineries modernes utilisent presque exclusivement le craquage catalytique fluide (FCC) pour son contrôle supérieur et la qualité de ses produits.
- Si votre objectif principal est de produire des alcènes fondamentaux (éthène/propène) : Une forme spécifique de craquage thermique à haute température appelée « vapocraquage » reste la méthode industrielle dominante à cette fin.
- Si votre objectif principal est de changer l'état d'un matériau sans altérer sa chimie : Vous recherchez un processus physique comme l'évaporation thermique ou la distillation, et non un processus chimique comme le craquage.
Comprendre la différence fondamentale entre la rupture des liaisons chimiques et le changement des états physiques est la clé pour maîtriser ces processus industriels essentiels.
Tableau récapitulatif :
| Aspect | Craquage Thermique |
|---|---|
| Type de processus | Décomposition Chimique |
| Condition clé | Haute Température (450-750°C) et Pression |
| Mécanisme | Réaction en chaîne par radicaux libres |
| Intrant principal | Hydrocarbures lourds (ex. : Gazole) |
| Produits principaux | Essence, Alcènes (ex. : Éthène, Propène) |
Besoin d'un traitement thermique précis pour votre travail en laboratoire ?
Que vous développiez de nouveaux matériaux ou analysiez des échantillons d'hydrocarbures, disposer de l'équipement adéquat est crucial pour obtenir des résultats précis et reproductibles. Les processus thermiques tels que l'évaporation, la distillation et la décomposition contrôlée sont fondamentaux pour la réussite en laboratoire.
Chez KINTEK, nous sommes spécialisés dans les équipements et consommables de laboratoire de haute qualité conçus pour répondre aux exigences rigoureuses des laboratoires modernes. Notre gamme d'équipements de traitement thermique peut vous aider à :
- Atteindre un contrôle précis de la température pour vos expériences.
- Améliorer l'efficacité et la sécurité de vos processus.
- Obtenir des données fiables et cohérentes.
Laissez KINTEK être votre partenaire d'innovation. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour vos besoins spécifiques en matière d'application thermique.
Guide Visuel
Produits associés
- Four de laboratoire tubulaire vertical
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
- Four à tube de laboratoire à haute température de 1700℃ avec tube en alumine
- Four rotatif à tubes multiples zones chauffantes divisées
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
Les gens demandent aussi
- Quelle est l'épaisseur standard du placage ? Optimiser la durabilité, la corrosion et le coût
- Pourquoi le chauffage augmente-t-il la température ? Comprendre la danse moléculaire du transfert d'énergie
- Qu'est-ce que le chauffage par tube de quartz ?Découvrez ses avantages et ses applications
- Quelle est la température de recuit des tubes ? Un guide des plages spécifiques aux matériaux pour des résultats optimaux
- Qu'est-ce qu'un four tubulaire vertical ? Exploitez la gravité pour une uniformité supérieure et un contrôle du processus



















